Đề thi giữa kì 1 Khoa học tự nhiên 7 năm 2023 – 2024 tuyển chọn 18 đề kiểm tra có ma trận kèm theo hướng dẫn đáp án chi tiết đầy đủ. Thông qua đề thi giữa kì 1 Khoa học tự nhiên 7 quý thầy cô có thêm nhiều tài liệu tham khảo để ra đề thi, ôn tập cho các em học sinh của mình.
Bạn đang đọc: Bộ đề thi giữa học kì 1 môn Khoa học tự nhiên lớp 7 năm 2023 – 2024 (Sách mới)
TOP 18 Đề kiểm tra giữa kì 1 Khoa học tự nhiên 7 gồm sách Kết nối tri thức, Chân trời sáng tạo, Cánh diều được biên soạn với nhiều mức độ câu hỏi khác nhau. Hi vọng qua tài liệu này sẽ là người bạn đồng hành giúp các em học sinh lớp 7 dễ dàng ôn tập, hệ thống kiến thức, luyện giải đề, rồi so sánh kết quả thuận tiện hơn. Vậy sau đây là trọn bộ 18 đề thi giữa kì 1 Khoa học tự nhiên 7 mời các bạn cùng theo dõi.
TOP 18 Đề thi giữa học kì 1 lớp 7 môn KHTN năm 2023
Đề thi giữa học kì 1 lớp 7 môn KHTN Chân trời sáng tạo
Đề kiểm tra giữa kì 1 KHTN 7
I. PHẦN TRẮC NGHIỆM (4,0 điểm)
Hãy chọn đáp án đúng nhất điền vào bảng trả lời trắc nghiệm trong phần bài làm
1. Phương pháp và kĩ năng học tập môn Khoa học tự nhiên (2 câu)
Câu 1 (B): Để đo chính xác độ dày của một quyển sách KHTN 7, người ta dùng
A. cân đồng hồ.
B. thước đo độ chia nhỏ nhất là 1mm.
C. nhiệt kế thuỷ ngân.
D. ước lượng bằng mắt thường.
Câu 2 (H): Phương pháp tìm hiểu tự nhiên được thực hiện qua các bước:
(1) Đưa ra dự đoán khoa học đẻ giải quyết vấn đề;
(2) Rút ra kết luận;
(3) Lập kế hoạch kiểm tra dự đoán;
(4) Đề xuất vấn đề cần tìm hiểu;
(5) Thực hiện kế hoạch kế hoạch kiểm tra dự đoán.
Em hãy sắp xếp các bước trên cho đúng thứ tự của phương pháp tìm hiểu tự nhiên.
A. (1); (2); (3); (4); (5).
B. (5); (4); (3); (2); (1).
C. (4); (1); (3); (5); (2).
D. (3); (4); (1); (5); (2).
2. Nguyên tử (2 câu)
Câu 3 (B): Trong các loại hạt cấu tạo nên nguyên tử, hạt mang điện tích âm là
A. electron.
B. electron và neutron.
C. proton.
D. proton và neutron.
Câu 4 (H): Trừ hạt nhân của nguyên tử hydrogen, hạt nhân các nguyên tử còn lại được tạo thành từ hạt
A. electron và proton.
B. electron, proton và neutron.
C. neutron và electron.
D. proton và neutron.
3. Nguyên tố hoá học (4 câu)
Câu 5 (B): Nguyên tố magnesium có kí hiệu hóa học là
A. mg.
B. Mg.
C. mg.
D. mG.
Câu 6 (B): Đến nay con người đã tìm ra bao nhiêu nguyên tố hóa học
A. 90.
B. 100.
C. 118.
D. 1180.
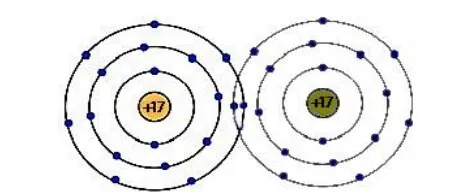
Câu 7 (H): Hình bên mô tả cấu tạo nguyên tử oxygen.Số hiệu nguyên tử (số proton) của nguyên tố oxygen là
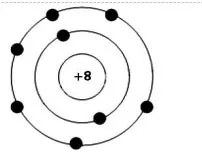
A. 6.
B. 7.
C. 8.
D. 9.
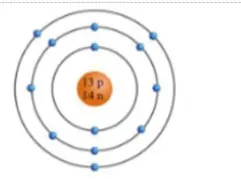
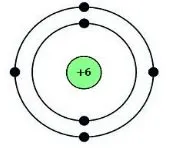
Câu 8 (H): Cho biết sơ đồ cấu tạo nguyên tử của nguyên tố như hình bên.Nguyên tố trên là
A. Be.
B. C
C. O.
D. Na.
Câu 9 (B): Bảng tuần hoàn các nguyên tố hoá học có
A. 7 nhóm A.
B. 8 nhóm A.
C. 9 nhóm A.
D. 10 nhóm A.
Câu 10 (B): Các kim loại kiềm trong nhóm IA đều có số electron lớp ngoài cùng là
|
A. A. 1e. |
B. B. 2e. |
C. C. 3e. |
D. D. 7e. |
5. Phân tử- Đơn chất – Hợp chất ( 6 câu)
Câu 11 (B): Chất nào dưới đây là đơn chất?
A. CO.
B. NaCl.
C. H2S.
D. O2.
Câu 12 (H): Dãy chỉ gồm toàn hợp chất là
A.FeO, NO, C, S.
B. Mg, K, S, C.
C. Fe, NO2, H2O, CuO.
D. CuO, KCl, HCl, CO2
Giới thiệu về liên kết hoá học
Câu 13 (B) Phân tử nào dưới đây được hành thành từ liên kết ion?
|
A. NaCl. |
B.H2. |
C. C. O2 |
D. H2O. |
Câu 14 (B): Trong phân tử O2, hai nguyên tử O đã liên kết với nhau bằng
|
A. 1 cặp electron dùng chung. |
B. 2 cặp electron dùng chung. |
|
C. 3 cặp electron dùng chung. |
D. 4 cặp electron dùng chung. |
Hoá trị và công thức hoá học
Câu 15 (B): Con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác là
A. Số hiệu nguyên tử.
B. Hoá trị.
C. Khối lượng nguyên tử.
D. Số liên kết của các nguyên tử.
Câu 16 (B): Cho potassium (K) có hoá trị I, Oxygen (O) hoá trị II. Công hoá hoá học potassium oxide là
A. KO
B. K2O
C. K2O2
D. KO2
II. PHẦN TỰ LUẬN (6,0 điểm)
Câu 17 (H) (1,0 điểm): Quan sát hình mô phỏng cấu tạo các nguyên tử dưới đây và trả lời các câu hỏi sau:
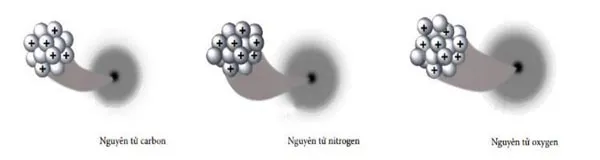
a) Số hạt proton của nguyên tử trong các hình trên là bao nhiêu?
b) Vì sao mỗi nguyên tử trung hoà về điện?
Câu 18 (VD) (0,5 điểm): Tổng số hạt của nguyên tố oxygen là 49. Biết số hạt mang điện tích âm là 16. Tính số hạt còn lại.
Câu 19 (H)(1,0 điểm): Cho sơ đồ cấu tạo của nguyên tử chlorine (Cl) như hình bên:
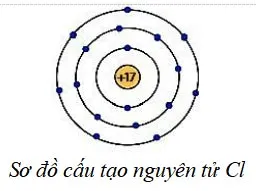
Hãy biểu diễn sự hình thành liên kết hoá trị trong phân tử Cl2.
Câu 20 (2,5 điểm):
a. (B) Nêu nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn.
Trong bảng tuần hoàn, nguyên tố khí hiếm nằm ở nhóm nào? ( đvkt thuộc 4. Sơ lược về bảng tuần hoàn các nguyên tố hoá học)
b. (H) Nguyên tố A có số hiệu nguyên tử là 6.
Cho biết vị trí của nguyên tố A trong bảng tuần hoàn nguyên tố hóa học.
Nguyên tố A là kim loại, phi kim hay khí hiếm? (Đvkt thuộc 3. Nguyên tố hoá học)
c. (VD) Trong mật ong có nhiều fructose. Phân tử fructose gồm 6 nguyên tử C, 12 nguyên tử H và 6 nguyên tử O. Hãy viết công thức hoá học của fructose và tính khối lượng phân tử fructose. (Đvkt thuộc 5. Phân tử- Đơn chất – Hợp chất)
7. Hoá trị và công thức hoá học
Câu 21 (VDC) (1,0 điểm): Một oxide có công thức XOn, trong đó X chiếm 30,43% về khối lượng. Biết khối lượng phân tử của oxide bằng 46 amu. Xác định công thức hoá học của oxide trên.
Đáp án đề thi giữa kì 1 KHTN 7
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
Đáp án |
B |
C |
A |
D |
B |
C |
C |
B |
B |
A |
D |
D |
B |
B |
B |
B |
II. PHẦN TỰ LUẬN
|
Câu |
ý |
Nội dung |
Điểm |
|
17 |
a |
Số hạt p của carbon là 6, của nitrogen là 7, của oxygen là 8 |
0,25 0,25 0,25 |
|
b |
Vì số hạt e bằng số hạt p |
0,25 |
|
|
18 |
Có: số p = số e = 16 hạt số n = 49 – 16 – 16 = 17 hạt |
0,25 0,25 |
|
|
19 |
HS chỉ cần vẽ đúng, không cần vẽ đẹp vẫn ghi điểm tối đa |
1 |
|
|
20 |
a |
Nguyên tắc sắp xếp – Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. – Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng. – Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp thành một cột. |
0,25 0,25 0,25 |
|
Trong bảng tuần hoàn nguyên tố khí hiếm nằm ở nhóm VIIIA |
0,25 |
||
|
b |
Nguyên tố A có số hiệu nguyên tử là 6 nên nguyên tố A ở + Ô số 6 + Chu kì 2 + Phân nhóm IVA. |
0,25 0,25 0,25 |
|
|
Nguyên tố A là phi kim |
0,25 |
||
|
c |
Fructose là hợp chất. Phân tử khối Fructose = 12 x 6 + 12 + 16 x 6 = 180 amu |
0,25 0,25 |
|
|
21 |
Khối lượng của X = 30,43 x 46/100 = 14 amu Khối lượng của O = 46 – 14 = 32 amu Số nguyên tử O = 32: 16 = 2 Vậy công thức cần tìm là NO2 |
0,25 0,25 0,25 0,25 |
Ma trận đề thi giữa kì 1 KHTN 7
|
Chủ đề |
MỨC ĐỘ |
Tổng số ý/câu |
Điểm số |
||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
||||||||
|
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
1. Phương pháp và kĩ năng học tập môn Khoa học tự nhiên (5 tiết) |
1 (0,25 đ) |
1 (0,25 đ) |
|
|
2 |
0,5 |
|||||
|
2. Nguyên tử (6 tiết) |
2 (0,5 điểm) |
1(1 điểm) 2đvkt |
|
1 (0,5 điểm) 1đvkt |
|
|
2 |
2 |
2,0 |
||
|
3. Nguyên tố hoá học (3 tiết) |
2 (0,5 đ) |
2(0,5 đ) |
|
|
4 |
1,0 |
|||||
|
4. Sơ lược về bảng tuần hoàn các nguyên tố hoá học (7 tiết) |
1 (1đ) 2đvkt |
2 (0,5 đ) |
|
1 (1 đ) 2đvkt |
|
|
2 |
2 |
2,5 |
||
|
5. Phân tử- Đơn chất – Hợp chất (4 tiết) |
1(0,25 đ) |
1(0,25đ) |
1 (0,5đ) 2đvkt |
|
|
|
1 |
4 |
1,0 |
||
|
6. Giới thiệu về liên kết hoá học (4 tiết) |
2(0,5 đ) |
1(1đ) 1đvkt |
|
|
|
1 |
2 |
1,5 |
|||
|
7. Hoá trị và công thức hoá học (3 tiết) |
2 (0,5 điểm) |
|
|
1(1 đ) |
|
1 |
1,5 |
||||
|
Số đơn vị kiến thức |
3 |
12 |
3 |
4 |
3 |
|
1 |
|
16 |
10 |
26 |
|
Điểm số |
1 |
3 |
2 |
1 |
2 |
|
1 |
|
7 |
16 |
10 |
|
Tổng số điểm |
4,0 điểm |
3,0 điểm |
2,0 điểm |
1,0 điểm |
10 điểm |
10 điểm |
|||||
b) Bản đặc tả
|
Nội dung |
Mức độ |
Yêu cầu cần đạt |
Số ý TL/số câu hỏi TN |
Câu hỏi |
||
|
TL (Số ý) |
TN (Số câu) |
TL (Số ý) |
TN (Số câu) |
|||
|
1. Phương pháp và kĩ năng học tập môn Khoa học tự nhiên (5 tiết) |
|
2 |
||||
|
Một số phương pháp trong học tập môn Khoa học tự nhiên (Phương pháp tìm hiểu tự nhiên; kĩ năng tiến trình: quan sát, phân loại, liên kết, đo, dự báo) |
Nhận biết |
– Biết được một số phương pháp và kĩ năng trong học tập môn Khoa học tự nhiên. |
|
1 |
C1 |
|
|
– Sử dụng được một số dụng cụ đo trong môn Khoa học tự nhiên 7 |
|
|
||||
|
Thông hiểu
|
Trình bày được một số phương pháp và kĩ năng trong học tập môn Khoa học tự nhiên: + Phương pháp tìm hiểu tự nhiên; |
|
1 |
C2 |
||
|
+ Thực hiện được các kĩ năng tiến trình: quan sát, phân loại, liên kết, đo, dự báo; |
||||||
|
+ Sử dụng được một số dụng cụ đo (trong nội dung môn Khoa học tự nhiên 7); |
|
|||||
|
+ Làm được báo cáo, thuyết trình. |
|
|
||||
|
Vận dụng
|
– Vận dụng được một số phương pháp và kĩ năng trong học tập môn Khoa học tự nhiên: + Phương pháp tìm hiểu tự nhiên; |
|
|
|||
|
+Thực hiện được các kĩ năng tiến trình: quan sát, phân loại, liên kết, đo, dự báo; |
|
|
||||
|
+ Sử dụng được một số dụng cụ đo (trong nội dung môn Khoa học tự nhiên 7); |
|
|
||||
|
+ Làm được báo cáo, thuyết trình. |
|
|||||
|
Vận dung cao |
Vận dung các phương pháp học tập môn khoa học tự nhiên từ đó đề xuất phương pháp bảo vệ môi trường; |
|
||||
|
2. Nguyên tử (6 tiết) |
2 |
2 |
||||
|
– Mô hình nguyên tử của Rutherford – Bohr (mô hình sắp xếp electron trong các lớp vỏ nguyên tử). – Khối lượng của một nguyên tử theo đơn vị quốc tế amu (đơn vị khối lượng nguyên tử). |
Nhận biết |
– Biết thành phần cấu tạo nguyên tử |
|
1 |
C3 |
|
|
|
|
|||||
|
– Biết được mô hình nguyên tử của Rutherford – Bohr (mô hình sắp xếp electron trong các lớp vỏ nguyên tử). |
|
|
||||
|
– Biết được khối lượng của một nguyên tử theo đơn vị quốc tế amu (đơn vị khối lượng nguyên tử). |
|
|||||
|
Thông hiểu |
– Trình bày được mô hình nguyên tử của Rutherford – Bohr (mô hình sắp xếp electron trong các lớp vỏ nguyên tử). |
|
|
|||
|
– Nêu được khối lượng của một nguyên tử theo đơn vị quốc tế amu (đơn vị khối lượng nguyên tử). |
|
|
||||
|
– Hiểu cấu tạo nguyên tử; khối lượng của các nguyên tử; điện tích của các thành phần cấu tạo nên nguyên tử. |
1 |
1 |
C17 |
C4 |
||
|
Vận dụng |
– Từ mô hình mô tả nguyên tử xác định số lượng các thành phần cấu tạo nên nguyên tử; |
|
|
|||
|
– Từ số lượng các thành phần cấu tạo nên nguyên tử mô tả cấu tạo nguyên tử theo mô hình. |
1 |
|
C18 |
|||
|
Vận dung cao |
– Giải các bài tập liên quan đến các loại hạt cấu tạo nên nguyên tử |
|
|
|||
|
3. Nguyên tố hoá học (3 tiết) |
|
4 |
||||
|
– Phát biểu được khái niệm về nguyên tố hoá học và kí hiệu nguyên tố hoá học. – Viết được công thức hoá học và đọc được tên của 20 nguyên tố đầu tiên. |
Nhận biết |
– Biết được khái niệm về nguyên tố hoá học và kí hiệu nguyên tố hoá học. – Biết số lượng nguyên tố hoá học con người đã tìm ra |
|
1 |
C6 |
|
|
– Biết được công thức hoá học và đọc được tên của 20 nguyên tố đầu tiên. |
|
1 |
C5 |
|||
|
Thông hiểu |
– Hiểu được khái niệm về nguyên tố hoá học và kí hiệu nguyên tố hoá học. – Từ mô hình nô tả nguyên tử xác định số lượng các loại hạt trong nguyên tử – Từ mô hình mô tả nguyên tử xác định kí hiệu nguyên tử – Từ số hiệu nguyên tử xác định vị trí của nguyên tố trong bảng tuần hoàn |
1 |
1
1 |
C20b |
C7 C8 |
|
|
Vận dụng |
– Từ số hiệu nguyên tử xác định số lượng hạt e, p của nguyên tử và ngược lại. |
|
|
|||
|
– Từ tên nguyên tố hoá học xác định được kí hiệu của nguyên tố hoá học và ngược lại |
|
|
||||
|
– Xác định được khối lượng các hạt và khối lượng nguyên tử theo đơn vị amu. |
|
|
||||
|
Vận dụng cao
|
– Viết một đoạn văn ngắn khoảng 100 từ về đề tài “Mô tả vai trò của các nguyên tố hoá học trong cuộc sống con người”. – Tìm hiệu thành phần của muối ăn và nêu vai trò của muối ăn với con người |
|
|
|||
|
4. Sơ lược về bảng tuần hoàn các nguyên tố hoá học (7 tiết) |
2 |
2 |
||||
|
Nêu được các nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học. Mô tả được cấu tạo bảng tuần hoàn gồm: ô, nhóm, chu kì. Sử dụng được bảng tuần hoàn để chỉ ra các nhóm nguyên tố/nguyên tố kim loại, các nhóm nguyên tố/nguyên tố phi kim, nhóm nguyên tố khí hiếm trong bảng tuần hoàn. |
Nhận biết |
– Nêu được các nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học. |
1 |
1 |
C20a |
C9 |
|
– Mô tả được cấu tạo bảng tuần hoàn gồm: ô, nhóm, chu kì. – Biết số electron lớp ngoài cùng của các nguyên tố trong các nhóm chính |
|
1 |
C10 |
|||
|
Thông hiểu |
– Sử dụng được bảng tuần hoàn để chỉ ra các nhóm nguyên tố/nguyên tố kim loại, các nhóm nguyên tố/nguyên tố phi kim, nhóm nguyên tố khí hiếm trong bảng tuần hoàn. |
|
|
|||
|
|
|
|
||||
|
Vận dụng |
– Dựa vào Số hiệu nguyên tử xác định vị trí (ô nguyên tố, chu kỳ, nhóm) của nguyên tố trong bảng tuần hoàn. |
|
|
|||
|
5. Phân tử- Đơn chất – Hợp chất (4 tiết) |
1 |
2 |
||||
|
– Nêu được khái niệm phân tử, đơn chất, hợp chất. Đưa ra được một số ví dụ về đơn chất và hợp chất. Tính được khối lượng phân tử theo đơn vị amu. |
Nhận biết |
– Nêu được khái niệm phân tử, đơn chất, hợp chất. – Biết được công thức hoá học của đơn chất hân tử, đơn chất, hợp chất. |
|
1 |
C11 |
|
|
Thông hiểu |
– Phân biệt đơn chất và hợp chất. – Xác định được các hợp chất trong dãy các chất. |
|
1 |
C12 |
||
|
Vận dụng |
– Tính được khối lượng phân tử theo đơn vị amu. |
1 |
|
C20c |
||
|
6. Giới thiệu về liên kết hoá học (4 tiết) |
1 |
2 |
||||
|
– Nêu được mô hình sắp xếp electron trong vỏ nguyên tử của một số nguyên tố khí hiếm; sự hình thành liên kết cộng hoá trị theo nguyên tắc dùng chung electron để tạo ra lớp vỏ electron của nguyên tố khí hiếm (Áp dụng được cho các phân tử đơn giản như H2, Cl2, NH3, H2O, CO2, N2,….). ion có lớp vỏ electron của nguyên tố khí hiếm (Áp dụng cho phân tử đơn giản như NaCl, MgO,…). – Chỉ ra được sự khác nhau về một số tính chất của chất ion và chất cộng hoá trị. |
Nhận biết |
– Nêu được các loại liên kết hoá học |
|
|
||
|
– Biết được một số hợp chất được tạo thành từ loại liên kết nào – Biết số số lượng cặp electron được hình trong liên kết công hoá trị |
|
1 1 |
C13 C14 |
|||
|
Thông hiểu |
– Nêu được mô hình sắp xếp electron trong vỏ nguyên tử của một số nguyên tố khí hiếm; sự hình thành liên kết cộng hoá trị theo nguyên tắc dùng chung electron để tạo ra lớp vỏ electron của nguyên tố khí hiếm (Áp dụng được cho các phân tử đơn giản như H2, Cl2, NH3, H2O, CO2, N2,….). |
1 |
|
C19 |
||
|
– Nêu được được sự hình thành liên kết ion theo nguyên tắc cho và nhận electron để tạo ra ion có lớp vỏ electron của nguyên tố khí hiếm (Áp dụng cho phân tử đơn giản như NaCl, MgO,…). |
|
|||||
|
– Chỉ ra được sự khác nhau về một số tính chất của chất ion và chất cộng hoá trị. |
|
|
||||
|
Vận dụng cao |
|
|
||||
|
|
|
|||||
|
|
|
|
||||
|
7. Hoá trị và công thức hoá học (3 tiết) |
|
|
||||
|
-Khái niệm về hoá trị (cho chất cộng hoá trị). Cách viết công thức hoá học. -Viết công thức hoá học của một số chất và hợp chất đơn giản thông dụng. – Mối liên hệ giữa hoá trị của nguyên tố với công thức hoá học. -Thành phần trăm (%) nguyên tố trong hợp chất |
Nhận biết |
– Biết được khái niệm hoá trị (cho chất cộng hoá trị). – Xác định được công thức hóa học của hợp chất khi biết hóa trị của các nguyên tố tạo nên hợp chất. – Trình bày được khái niệm về hoá trị (cho chất cộng hoá trị). Cách viết công thức hoá học. |
|
1 1 |
C15 C16 |
|
|
– Nêu được mối liên hệ giữa hoá trị của nguyên tố với công thức hoá học. |
|
|||||
|
Thông hiểu |
– Tính được phần trăm (%) nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất. |
|
|
|||
|
– Tính được phần trăm (%) nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất. |
|
|||||
|
Vận dụng |
Xác định được công thức hoá học của hợp chất dựa vào phần trăm (%) nguyên tố và khối lượng phân tử.
|
1 |
C21 |
|||
Đề thi giữa kì 1 Khoa học tự nhiên 7 Cánh diều
Đề kiểm tra giữa kì 1 KHTN 7
|
TRƯỜNG THCS ………….. Lưu ý: Đề bài gồm 03 trang học sinh làm bài vào giấy kiểm tra
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ I Năm học 2023 – 2024 Môn: KHTN 7 – Tiết 35, 36 Thời gian làm bài: 60 phút (Không kể thời gian giao đề) |
I. TRẮC NGHIỆM (6,0 điểm).
Chọn chỉ một phương án trả lời đúng trong các phương án A, B, C, D D rồi ghi vào giấy kiểm tra.
Câu 1. Phát biểu nào sau đây không mô tả đúng mô hình nguyên tử của Rơ-dơ-pho – Bo?
A. Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở tâm nguyên tử và các electron ở vỏ nguyên tử
B. Nguyên tử có cấu tạo đặc khít, gồm hạt nhân nguyên tử và các electron.
C. Electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định tạo thành các lớp electron.
D. Hạt nhân nguyên tử mang điện tích dương, electron mang điện tích âm.
Câu 2. Cho mô hình cấu tạo nguyên tử aluminium:
|
Nguyên tử aluminium có bao nhiêu lớp electron và có bao nhiêu electron ở lớp ngoài cùng? A. Có 3 lớp electron và có 6 electron ở lớp ngoài ngoài cùng. |
|
Câu 3. Kí hiệu hoá học của nguyên tố calcium là
A.Fe.
B. Cu.
C. Ca.
D. Al.
Câu 4. Sulfur là tên nguyên tố hóa học được kí hiệu là:
A. P
B. Cl
C. Ca
D. S
Câu 5. Kí hiệu hóa học của các nguyên tố sau: Sodium, Auminium, Nitrogen lần lượt là các KHHH nào ?
A. Na, Al, H.
B. Na, Al, N.
C.Al, Ba, N
D. Ba, Al, H
Câu 6. Kí hiệu hóa học N là của nguyên tố hóa học nào?
A. Sodium.
B. Nitrogen.
C. Auminium.
D. Oxygen.
Câu 7. Bảng tuần hoàn các nguyên tố hoá học được cấu tạo từ
A. Ô nguyên tố, chu kì, nhóm.
B.Chu kì, nhóm.
C. Ô nguyên tố.
D. Chu kì.
Câu 8. Phát biểu nào sau đây là đúng?
A. Bảng tuần hoàn gồm 116 nguyên tố hoá học.
B. Bảng tuần hoàn gồm 6 chu kì.
C. Bảng tuần hoàn gồm 8 nhóm A và 8 nhóm B.
D. Các nguyên tố trong bảng tuần hoàn được xếp theo chiều tăng dần khối lượng nguyên tử.
Câu 9. Nhóm A là tập hợp các nguyên tố mà nguyên tử
A. Có số electron lớp ngoài cùng bằng nhau.
B. Có số lớp electron bằng nhau.
C. Có điện tích hạt nhân bằng nhau.
D. Có số hạt trong nguyên tử bằng nhau.
Câu 10. Phát biểu nào sau đây không đúng?
A. Bảng tuần hoàn gồm 3 chu kì nhỏ và 4 chu kì lớn.
B. Số thứ tự của chu kì bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì đó.
C. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố
thuộc chu kì đó.
D. Các nguyên tố trong cùng chu kì được sắp xếp theo chiều điện tích hạt
nhân tăng dần.
Câu 11. Trong các chất sau, chất nào là đơn chất kim loại?
A. CaO
B. N2
C. Cu
D. AgNO3
Câu 12. Dãy chất nào sau đây chỉ gồm công thức hóa học của các hợp chất?
A. Na2CO3, NaOH,Cu
B. NH3, NaCl, H2O
C.NaCl, H2O, H2
D. HCl, NaCl, O2
Câu 13. Hai nguyên tử hydrogen liên kết với nhau tạo thành 1 phân tử hydrogen bởi?
A.Liên kết cộng hóa trị
C. Liên kết hidro
B.Liên kết ion
D. Liên kết ion và liên kết CHT.
Câu 14. Liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử là liên kết nào?
A. Liên kết hydrogen.
B. Liên kết kim loại.
C. Liên kết ion.
D. Liên kết cộng hóa trị.
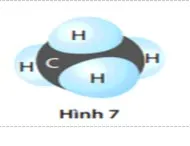
Câu 15. Cho hình 7 mô tả phân tử khí methane (CH4)
|
Trong hợp chất này, nguyên tử C sử dụng bao nhiêu electron lớp ngoài cùng của nó để tạo các liên kết cộng |
|
A. 2.
B. 4.
C. 8.
D. 10.
Câu 16. Chọn câu sai
A. Hóa tri là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố kia
B. Hoá trị của một nguyên tố được xác định theo hóa trị của H chọn làm đơn vị và hóa trị của oxi là 2 đơn vị
C. Quy tắc hóa trị : x.a=y.b
D. Phosphorus chỉ có hóa trị IV
II. TỰ LUẬN (6,0 điểm).
Câu 17 (1,5 điểm). Trình bày phương pháp tìm hiểu tự nhiên?
Câu 18 (1,5 điểm). a, Viết tên và kí hiệu của nguyên tố hóa học, hoàn thành bảng sau
|
STT |
Tên nguyên tố hóa học |
Kí hiệu hóa học |
STT |
Tên nguyên tố hóa học |
Kí hiệu hóa học |
|
1 |
He |
6 |
beryllium |
||
|
2 |
Ar |
7 |
magnesium |
||
|
3 |
B |
8 |
aluminium |
||
|
4 |
Ne |
9 |
phosphorus |
||
|
5 |
S |
10 |
oxygen |
b, Mô tả cấu tạo bảng tuần hoàn nguyên tố hóa học: ô, nhóm, chu kì
Câu 19 (1,0 điểm).
|
Quan sát ô nguyên tố và trả lời các câu hỏi sau: a) Em biết được thông tin gì trong ô nguyên tố calcium? b) Nguyên tố calcium này nằm ở vị trí nào (ô, nhóm, chu kì) trong bảng tuần hoàn các nguyên tố hóa học |
|
Câu 20 (1,0 điểm). Em tính khối lượng của chất theo đơn vị amu: H2, H2O, MgO, Al. Hợp chất NaCl thuộc loại liên kết hóa học nào?
Câu 21 (1,0 điểm). Copper (II) sulfate có trong thành phần của một số thuốc diệt nấm, trừ sâu và diệt cỏ cho cây trồng. Copper (II) sulfate được tạo thành từ Cu, S và O và có khối lượng phân tử là 160 amu. Phần trăm khối lượng của các nguyên tố Cu, S và O trong Copper (II) sulfate lần lượt là: 40%, 20% và 40%. Hãy xác định công thức hoá học của Copper (II) sulfate.
Đáp án đề thi giữa kì 1 Khoa học tự nhiên 7
I.TRẮC NGHIỆM (4,0 điểm)
Mỗi câu chọn đúng 0,25 điểm
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
Chọn |
B |
B |
C |
D |
B |
B |
A |
C |
A |
B |
C |
B |
A |
D |
B |
D |
II. TỰ LUẬN (6,0 điểm )
|
Câu |
Nội dung |
Điểm |
||||||||||
|
17 |
Phương pháp tìm hiểu tự nhiên gồm 5 bước: – Đề xuất vấn đề cùng tìm hiểu – Đưa ra dự đoán khoa học để giải quyết vấn đề – Lập kế hoạch kiểm tra dự án – Thực hiện kế hoạch kiểm tra dự án – Viết báo cáo, thảo luận và trình bày báo cáo khi được yêu cầu. |
1,5 |
||||||||||
|
18 |
|
1,0 |
||||||||||
|
Cấu tạo bảng tuần hoàn hóa học – Ô nguyên tố: cho biết kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử và khối lượng nguyên tử. – Chu kì: cho biết số lớp electron, xếp theo chiều điện tích hạt nhân tăng dần đi từ trái sang phải. gồm 7 chu kì. – Nhóm: Gồm 8 nhóm A, 8 nhóm B, cho biết số electron lớp ngoài cùng |
0,5 |
|||||||||||
|
19 |
a.Từ ô nguyên tố của calcium, ta biết được: + Số thứ tự của ô: 20. + Kí hiệu nguyên tố: Ca. + Tên nguyên tố: calcium. + Khối lượng nguyên tử: 40. |
0,5 |
||||||||||
|
|
b) Vị trí của nguyên tố calcium: + Ô: 20. + Nhóm: IIA. + Chu kì: 3. |
0,5 |
||||||||||
|
20 |
Tính khối lượng của chất theo đơn vị amu: + H2O: 18amu + NaCl: 58,5amu + Al: 27amu + MgO: 40amu |
0,5 |
||||||||||
|
NaCl thuộc loại liên kết ion. |
0,5 |
|||||||||||
|
21 |
Gọi công thức của Copper (II) sulfate là Cux SyOz. Vậy ta có: ( 64x:160 ) x 100% = 40% → x = 1 (32y : 160 ) x 100% = 20% → y = 1 (16z : 160 ) x 100% = 40% → z = 4 Vậy công thức của Copper (II) sulfate là: CuSO4 |
0,25 0,25 0,25 0,25 |
Ma trận đề thi giữa kì 1 Khoa học tự nhiên 7
|
Chủ đề |
MỨC ĐỘ ĐÁNH GIÁ |
Tổng số ý/câu |
Điểm số |
||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
||||||||
|
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
Tự luận |
Trắc nghiệm |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
Mở đầu |
1(1,5) |
1 |
1,5 |
||||||||
|
Nguyên tử. Nguyên tố hoá học |
2 |
1 (1,0) |
4 |
1 |
6 |
2,5 |
|||||
|
Sơ lược về bảng tuần hoàn các nguyên tố hoá học |
1(0,5) |
4 |
2 (1,0) |
3 |
4 |
2,5 |
|||||
|
Phân tử |
|||||||||||
|
Phân tử; đơn chất; hợp chất |
1(0,5) |
2 |
1 |
2 |
1,0 |
||||||
|
Giới thiệu về liên kết hoá học (ion, cộng hoá trị) |
1(0,5) |
2 |
1 |
2 |
1,0 |
||||||
|
Hoá trị; công thức hoá học |
2 |
2 |
2 |
1,5 |
|||||||
|
Tổng số ý/ câu |
2 |
8 |
5 |
8 |
2 |
|
|
|
7 |
16 |
10,00 |
|
Điểm số |
2,0 |
2,0 |
3,0 |
2,0 |
1,0 |
|
|
|
6,0 |
4,0 |
10 |
|
Tổng số điểm |
4,0 điểm |
5,0 điểm |
1,0 điểm |
0 điểm |
10 điểm |
10 điểm |
|||||
Đề thi giữa kì 1 KHTN 7 Kết nối tri thức
Đề thi KHTN lớp 7 giữa kì 1
I. PHẦN TRẮC NGHIỆM
Câu 1. Nguyên tố X có số thứ tự 15 trong bảng tuần hoàn, nguyên tố đó nằm ở chu kỳ:
A. 1
B. 4
C. 3
D. 2
Câu 2. Đơn chất là những chất được tạo nên từ:
A. 2 nguyên tố hóa học
B. 2 nguyên tử
C. nguyên tử oxi và nguyên tử hiđro
D. 1 nguyên tố hóa học
Câu 3. Một phân tử chứa 1 nguyên tử carbon, và 2 nguyên tử oxygen. CTHH của hợp chất đó là:
A. CO2
B. CO2
C. CO2
D. Co2
Câu 4. Nguyên tố X nằm ở chu kỳ II, nhóm VA trong bảng tuần hoàn, X là nguyên tố:
A. Nitrogen
B. Photphorus
C. Chlorine
D. Sulfur
Câu 5. Liên kết hóa học giữa các nguyên tử oxygen và hydrogen trong phân tử nước được hình thành bằng cách:
A. Nguyên tử oxygen và nguyên tử hydrogen góp chung proton
B. Nguyên tử oxygen nhận và nguyên tử hydrogen góp chung electron
C. Nguyên tử oxygen nhường electron, nguyên tử hydrogen nhận electron
D. Nguyên tử oxygen nhận electron, nguyên tử hydrogen nhường electron
Câu 6. Các nguyên tố trong bảng tuần hoàn các nguyên tố hoá học được sắp xếp theo thứ tự tăng dần của
A. khối lượng
B. số neutron
C. điện tích hạt nhân nguyên tử
D. tỉ trọng
Câu 7. Trong ô nguyên tố Sodium, con số 23 cho biết điều gì sau đây?
A. Số thứ tự của nguyên tố
B. Chu kỳ của nó
C. Khối lượng nguyên tử của nguyên tố đó
D. Số nguyên tử của nguyên tố
Câu 8. Hóa trị của một nguyên tố trong hợp chất là:
A. con số biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử khác trong phân tử.
B. con số biểu thị khả năng liên kết của phân tử này với phân tử khác
C. chữ cái biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử khác trong phân tử.
Câu 9. Con người có thể định lượng được các sự vật và hiện tượng tự nhiên dựa trên kĩ năng:
A. dự báo.
B. quan sát, phân loại.
C. liên kết tri thức.
D. đo.
Câu 10. Trên cơ sở phân tích các số liệu và phân tích số liệu, con người có thể đưa ra các dự báo hay dự đoán tính chất của sự vật, hiện tượng và nguyên nhân của hiện tượng, đó là kĩ năng:
A. dự báo
B. liên kết tri thức
C. đo
D. quan sát.
Câu 11. Phương pháp tìm hiểu tự nhiên được thực hiện qua bao nhiêu bước.
A. 7
B. 6
C. 4
D. 5
Câu 12. Phương pháp tìm hiểu tự nhiên được thực hiện qua các bước:
1. Quan sát và đặt câu hỏi nghiên cứu
2. Hình thành giả thuyết
3. Lập kế hoạch kiểm tra giả thuyết
4. Thực hiện kế hoạch
5. Kết luận
Thứ tự của các bước là:
A. 1-2-3-4-5
B. 4-1-3-5-2
C. 5-4-3-2-1
D. 3-4-1-5-2
Câu 13. Bảng tuần hoàn các nguyên tố hóa học được cấu tạo từ:
A. chu kỳ, nhóm
B. chu kỳ
C. ô nguyên tố
D. ô nguyên tố, chu kỳ, nhóm
Câu 14. Hợp chất là chất được tạo nên từ:
A. 2 hay nhiều nguyên tố hóa học
B. 3 nguyên tố hóa học
C. 1 nguyên tố hóa học
D. 2 nguyên tố hóa học
Câu 15. Chức năng quan trọng của dao động kí là gì?
A. Biến đổi tín hiệu âm truyền tới thành tín hiệu điện;
B. Tự động đo thời gian;
C. Hiển thị đồ thị của tín hiệu điện theo thời gian.
D. Đo chuyển động của một vật trên quãng đường;
Câu 16. Chất nào sau đây là đơn chất :
A. Nước
B. Muối ăn Sodium chloride
C. Oxygen
D. Đường Sucrose
Câu 17. Để đo chính xác độ dày của quyển sách KHTN lớp 7, người ta dùng.
A. Thước đo độ chia nhỏ nhất.
B. Ước lượng bằng mắt thường
C. Nhiệt kế thủy ngân
D. Cân đồng hồ
Câu 18. Liên kết giữa các nguyên tử trong phân tử nước là liên kết:
A. cộng hóa trị
B. ion
C. phi kim
D. kim loại
Câu 19. Trong Hình 1.1, ban đầu bình a chứa nước, bình b chứa một vật rắn không thấm nước. Khi đổ hết nước từ bình a sang bình b thì mức nước trong bình b được vẽ trong hình.
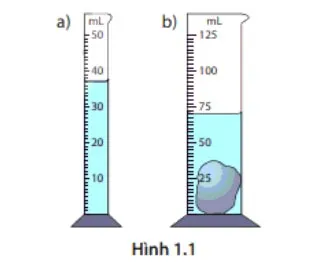
Thể tích của vật rắn là
A. 32,5 mL.
B. 35,2 mL.
C. 73 mL.
D. 33 mL.
Câu 20. Cách viết nào sau đây biểu diễn đúng CTHH của nguyên tố Sodium:
A. na
B. Na
C. nA
D. NA
II. PHẦN TỰ LUẬN
Câu 21: Nêu nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
Câu 22: Phân tử là gì?
Câu 23: Vẽ sơ đồ hình thành liên kết ion trong phân tử NaCl
Câu 24: Lập công thức hóa học của hợp chất tạo bởi Sulfur và Oxygen. Biết phần trăm khối lượng của Sulfur và Oxygen lần lượt là 40% và 60%. Khối lượng phân tử của hợp chất là 80 amu.
4
Câu 25: Cho hợp chất Fe2O3. Tính phần trăm khối lượng từng nguyên tố có trong hợp chất trên.
Đáp án đề kiểm tra giữa kì 1 KNTN 7
Phần trắc nghiệm 20(5đ = 20×0,25)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
C |
D |
C |
A |
A |
C |
C |
A |
D |
A |
D |
A |
D |
A |
C |
C |
B |
A |
D |
B |
Phần tự luận
Câu 21: Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn là theo chiều tăng dần của điện tích hạt nhân nguyên tử
Câu 22 (1đ = 0,25×4): Học sinh nêu được đúng và đầy đủ định nghĩa phân tử
-Phân tử là hạt đại diện cho chất
-Gồm 1 số nguyên tử liên kết với nhau
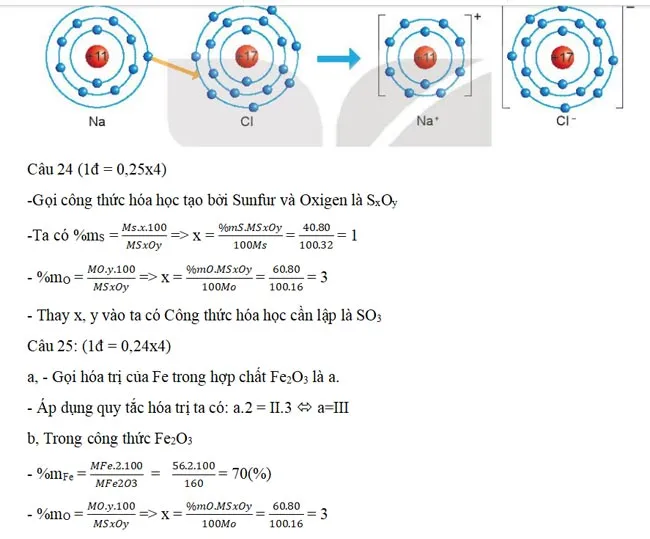
-Và thể hiện đầy đủ tính chất hóa học của chất
Câu 23 (1đ): Học sinh vẽ được như hình mô tả bên dưới
Vẽ sơ đồ hình thành liên kết ion trong phân tử NaCl
Ma trận đề thi giữa kì 1 KHTN 7
|
Chủ đề |
MỨC ĐỘ |
Tổng số câu TL/Tổng số ý TN |
Điểm số |
||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
||||||||
|
TL |
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
TN |
||
|
Chủ đề : Mở đầu (5 tiết) |
2 |
1 |
1 |
1 |
3 |
1,75 |
|||||
|
Chủ đề: Nguyên tử sơ lược bảng tuần hoàn các nguyên tố (15 tiết) |
10 |
2 |
1 |
1 |
12 |
5,0 |
|||||
|
Chủ đề : Phân tử ( 4 tiết) |
2 |
1 |
1 |
2 |
1,5 |
||||||
|
Chủ đề : Hóa trị ( 6 tiết) |
2 |
1 |
1 |
1 |
3 |
1,75 |
|||||
|
Số câu TL/Tổng số câu TN |
16 |
2 |
4 |
1 |
1 |
4 |
20 |
24 |
|||
|
Điểm số |
4 |
2 |
1 |
2 |
1 |
5 |
5 |
10,00 |
|||
|
Tổng số điểm |
4,0 điểm |
3,0 điểm |
2,0 điểm |
1,0 điểm |
10 điểm |
10 điểm |
|||||
BẢN ĐẶC TẢ
|
TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Yêu cầu cần đạt |
Số ý TL/ Số câu TN |
Câu hỏi |
||
|
TL ( số ý/câu) |
TN ( Số câu) |
TL ( số câu) |
TN ( Số câu) |
||||
|
1 |
Chủ đề : Mở đầu (5 tiết) |
Mở đầu |
Nhận biết Trình bày được một số phương pháp và kĩ năng trong học tập môn Khoa học tự nhiên |
2 |
C1,2 |
||
|
Thông hiểu – Thực hiện được các bước tìm hiểu tự nhiên ( 5 bước) – Thực hiện được các kĩ năng tiến trình: quan sát, phân loại, liên kết, đo, dự báo. – Sử dụng được một số dụng cụ đo(trong nội dung môn Khoa học tự nhiên 7). |
1 |
1 |
C21 |
C17 |
|||
|
2 |
Chủ đề: Nguyên tử, Sơ lược bảng tuần hoàn các nguyên tố (15 tiết) |
Nguyên tử Sơ lược về bảng tuần hoàn các nguyên tố hoá học |
Nhận biết – Biết được khái niêm nguyên tử, mô hình cấu tạo nguyên tử của rơ-dơ-pho-bo, nguyên tử khối; nguyên tố hoá học, KHHH của nguyên tố. – Biết được ứng dụng của một số nguyên tố kim loại, phi kim trong đời sống. – Nêu được các nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học. – Mô tả được cấu tạo bảng tuần hoàn gồm: ô, nhóm, chu kì. |
10 |
|
C3,4,5, 6,7,8,9, 10,11,12 |
|
|
Thông hiểu. – Từ mô hình cấu tạo nguyên tử chỉ ra số p, số e, số lớp e, số e lớp ngoài cùng. – Từ KHHH gọi tên nguyên tố và ngược lại. – Sử dụng được bảng tuần hoàn để chỉ ra các nhóm nguyên tố/nguyên tố kim loại, các nhóm nguyên tố/nguyên tố phi kim, nhóm nguyên tố khí hiếm trong bảng tuần hoàn. – Sử dụng BTH để tìm hiểu các thông tin về nguyên tố. |
2 |
C18,19 |
|||||
|
Vận dụng – Vẽ mô hình cấu tạo nguyên tử của 20 nguyên tố đầu trong bảng tần hoàn. – Biết cách tìm nguyên tố hoá học, dựa vào số hiệ nguyên tử (số P trong hạt nhân nguyên tử)
|
1 |
C23 |
|||||
|
3 |
Chủ đề : Phân tử ( 4 tiết) |
Phân tử; đơn chất; hợp chất |
Nhận biết Nêu được khái niệm phân tử, đơn chất, hợp chất. |
2 |
|
C13,14 |
|
|
Thông hiểu – Đưa ra được một số ví dụ về đơn chất và hợp chất. – Tính được khối lượng phân tử theo đơn vị amu. |
1 |
C22 |
|||||
|
5 |
Chủ đề : Hóa trị ( 6 tiết) |
Hoá trị; công thức hoá học |
Nhận biết – Nêu được khái niệm về hoá trị (cho chất cộng hoá trị). Cách viết công thức hoá học. – Nêu được mối liên hệ giữa hoá trị của nguyên tố với công thức hoá học. |
2 |
15,16 |
||
|
Thông hiểu – Viết được công thức hoá học của một số chất và hợp chất đơn giản thông dụng. – Tính được hoá trị một nguyên tố ( nhóm nguyên tố) trong hợp chất. – Lập được CTHH khi biết hoá trị. |
1 |
C20 |
|||||
|
Vận dụng. – Xác định CTHH viết đúng hay sai; sửa lại cho đúng dựa vào quy tắc hoá trị. – Tính được phần trăm (%) nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất. |
|
||||||
|
Vận dụng cao – Xác định được công thức hoá học của hợp chất dựa vào phần trăm (%) nguyên tố và khối lượng phân tử |
1 |
C24 |
|||||
|
Số câu TL/Tổng số câu TN |
4 |
20 |
|||||
…………..
Tải file tài liệu để xem thêm đề thi giữa kì 1 KHTN năm 2023 – 2024