Đề thi Hóa học giữa kì 1 lớp 10 Kết nối tri thức năm 2023 – 2024 bao gồm 5 đề thi giữa kì 1 có đáp án hướng dẫn giải chi tiết, chính xác và bảng ma trận. Thông qua đề thi giữa kì 1 Hóa học 10 quý thầy cô có thêm nhiều tài liệu tham khảo để ra đề thi cho các em học sinh của mình.
Bạn đang đọc: Bộ đề thi giữa học kì 1 môn Hóa học 10 năm 2023 – 2024 sách Kết nối tri thức với cuộc sống
TOP 5 Đề thi giữa kì 1 Hóa học 10 Kết nối tri thức được biên soạn rất đa dạng với mức độ câu hỏi khác nhau. Hi vọng qua tài liệu này sẽ là người bạn đồng hành giúp các em học sinh lớp 10 dễ dàng ôn tập, hệ thống kiến thức, luyện giải đề, rồi so sánh kết quả thuận tiện hơn. Vậy sau đây là trọn bộ 5 đề thi giữa kì 1 Hóa học 10 Kết nối tri thức mời các bạn cùng theo dõi. Bên cạnh đó các bạn xem thêm bộ đề thi giữa kì 1 môn Vật lí 10, bộ đề thi giữa kì 1 môn Ngữ văn 10.
Bộ đề thi giữa kì 1 Hóa 10 Kết nối tri thức (Có đáp án)
Đề thi giữa kì 1 Hóa 10 Kết nối tri thức – Đề 1
Đề thi giữa kì 1 Hóa học 10
|
TRƯỜNG THPT ………… Tổ: Khoa học Tự nhiên – |
ĐỀ KIỂM TRA GIỮA HỌC KỲ I – NĂM HỌC 2023-2024 Môn: Hóa học 10 – Bộ sách: Kết nối tri thức – Thời gian làm bài: 45 phút Đối tượng áp dụng: Chương trình Cơ bản + Chuyên đề học tập |
PHẦN 1. TRẮC NGHIỆM KHÁCH QUAN (7,0 điểm)
Anh/chị khoanh tròn vào chữ cái đặt trước câu trả lời đúng ứng với mỗi câu hỏi trắc nghiệm khách quan dưới đây.
Câu 1. Nhóm A bao gồm các nguyên tố:
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố d và nguyên tố f.
D. Nguyên tố s và nguyên tố p.
Câu 2. Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì
A. phi kim mạnh nhất là iot.
B. kim loại mạnh nhất là Li.
C. phi kim mạnh nhất là oxi.
D. phi kim mạnh nhất là F.
Câu 3. Cho các nguyên tử : 3Li, 8O, 9F, 11Na. Dãy sắp xếp theo thứ tự bán kính nguyên tử của tăng dần từ trái sang phải của các nguyên tố trên là
A. F, O, Li, Na.
B. F, Na, O, Li.
C. F, Li, O, Na.
D. Li, Na, O, F.
Câu 4. Nguyên tố R có tổng số hạt mang điện và không mang điện là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Kí hiệu và vị trí của R trong bảng tuần hoàn là:
A. Ne, chu kì 2, nhóm VIIIA.
B. Na, chu kì 3, nhóm IA.
C. Mg, chu kì 3, nhóm IIA.
D. F, chu kì 2, nhó VIIA.
Câu 5. Phát biểu nào sau đây là đúng?
A. Trong một chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố biến thiên tuần hoàn.
B. Trong một chu kì, số electron lớp ngoài cùng của nguyên tử các nguyên tố tăng dần.
C. Trong một chu kì, do số proton trong hạt nhân nguyên tử các nguyên tố tăng dần nên khối lượng nguyên tử tăng dần.
D. Trong một chu kì ngắn, số electron hóa trị của nguyên tử các nguyên tố tăng dần.
Câu 6. Phát biểu nào sau đây không đúng?
A. Trong số các nguyên tố bền, cesi là kim loại mạnh nhất.
B. Trong nhóm IVA vừa có nguyên tố kim loại, vừa có nguyên tố phi kim.
C. Tất cả các nguyên tố nhóm B đều là kim loại.
D. Đối với tất cả nguyên tố thuộc nhóm A của bảng tuần hoàn, số electron lớp ngoài cùng bằng số thứ tự nhóm.
Câu 7. Cho điện tích hạt nhân O (Z = 8), Na (Z = 11), Mg (Z = 12), Al (Z = 13) và các hạt vi mô: O2-, Al3+, Al, Na, Mg2+, Mg. Dãy nào sau đây được xếp đúng thứ tự bán kính hạt?
A. Al3+2+2-
B. Al3+2+ 2-.
C. Na 3+2+2-.
D. Na 2+ 3+ 2-.
Câu 8. Một nguyên tố Y đứng liền trước nguyên tố X trong cùng một chu kì của bảng tuần hoàn. Y đứng liền trước Z trong cùng một nhóm A. Phát biểu nào sau đây là đúng?
A. Số hiệu nguyên tử theo thứ tự tăng dần là X B. Bán kính nguyên tử theo thứ tự tang dần là Z C. Hóa trị cao nhất trong hợp chất với oxi tang dần theo thứ tự: Z D. Trong các hidroxit, tính axit tăng dần theo thứ tự: hydroxide của Z
Câu 9. Cấu hình electron nguyên tử của 3 nguyên tố X, Y, T lần lượt là: 1s22s22p63s1; 1s22s22p63s23p64s1; 1s22s22p63s23p1. Nếu xếp theo chiều tăng dần tính kim loại thì sự sắp xếp đúng
A. T B. T C. Y D. Y
Câu 10. Trong các mệnh đề sau:
(1) Nhóm B gồm cả các nguyên tố thuộc chu kì nhỏ và chu kì lớn.
(2) Bảng tuần hoàn gồm 4 chu kì và 8 nhóm.
(3) Nhóm A chỉ gồm các nguyên tố thuộc chu kì lớn.
(4) Các nguyên tố nhóm d và f còn được gọi là các nguyên tố kim loại chuyển tiếp.
Số mệnh đề phát biểu đúng là:
A. 3.
B. 2.
C. 1.
D. 4.
Câu 11. Ba nguyên tố R, Q, T là các nguyên tố thuộc nhóm A và lần lượt đứng liên tiếp cạnh nhau trong cùng một chu kì.
Có các phát biểu sau đây:
(1) Điện tích hạt nhân tăng dần theo thứ tự: R
(2) Bán kính nguyên tử tăng dần theo thứ tự: R
(3) Tính phi kim tăng dần theo thứ tự: R
(4) Khối lượng nguyên tử tăng dần theo thứ tự: R
(5) Hóa trị trong hợp chất với hidro tăng dần theo thứ tự: R
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 12. X và Y là hai nguyên tố thuộc nhóm A, trong cùng một chu kì lớn. Oxide cao nhất của X và Y có công thức hóa học là X2O3 và YO2.
Có các phát biểu sau đây:
(a) X và Y đứng cạnh nhau.
(b) X là kim loại còn Y là phi kim.
(c) Độ âm điện của X nhỏ hơn Y.
(d) Hợp chất của X và Y với hydrogen lần lượt là XH5 và YH4.
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 13. Nguyên tố X có cấu hình electron là 1s22s22p3. Vậy vị trí X trong bảng tuần hoàn và công thức hợp chất khí với hydrogen của X là:
A. Chu kì 2, nhóm VA, HXO3.
B. Chu kì 2, nhóm VA, XH4.
C. Chu kì 2, nhóm VA, XH3.
D. Chu kì 2, nhóm VA, XH2.
Câu 14. Khi xếp các nguyên tố hóa học theo chiều tăng dần điện tích hạt nhân, tính chất nào sau đây không biến đổi tuần hoàn?
A. Số electron lớp ngoài cùng.
B. Độ âm điện.
C. Năng lượng ion hóa.
D. Số khối.
Câu 15. X, Y, Z là 3 nguyên tố thuộc cùng một chu kì của bảng tuần hoàn hóa học. Biết oxit của X khi tan trong nước tạo thành một dung dịch làm hồng quỳ tím. Y phản ứng với nước làm xanh giấy quỳ tím, còn Z phản ứng được với cả axit và kiềm. Nếu sắp xếp theo trật tự tăng dần số hiệu nguyên tử thì trật tự đúng sẽ là:
A. X, Y, Z.
B. Y, Z, X.
C. X, Z, Y.
D. Z, Y, X.
Câu 16. X và Y là hai nguyên tố cùng thuộc một phân nhóm chính thuộc hai chu kì kế tiếp nhau trong bảng tuần hoàn. Tổng số proton trong hạt nhân của hai nguyên tố bằng 58. Số hiệu nguyên tử của X và Y lần lượt là
A. 25, 33.
B. 19, 3.9
C. 20, 38.
D. 24, 34.
Câu 17. X và Y là hai nguyên tố thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn, ở trạng thái đơn chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. X là
A. O.
B. S.
C. Mg.
D. P.
Câu 18. Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(1) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử ;
(2) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một hàng ;
(3) Các nguyên tố có cùng số electron hóa trị được xếp vào một cột ;
(4) Số thứ tự của ô nguyên tố bằng số hiệu của nguyên tố đó
Số nguyên tắc đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Câu 19. Mệnh đề nào sau đây không đúng?
A. Trong chu kì, các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần.
B. Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau.
C. Nguyên tử của các nguyên tố trong cùng phân nhóm bao giờ cũng có cùng số electron hóa trị.
D. Trong chu kì, các nguyên tố được sắp xếp theo chiều khối lượng nguyên tử tăng dần.
Câu 20. Vị trí của nguyên tử nguyên tố X có Z= 27 trong bảng tuần hoàn là
A. chu kì 4, nhóm VIIB.
B. chu kì 4, nhóm VIIIB.
C. chu kì 4,nhóm IIA.
D. chu kì 3, nhóm IIB.
Câu 21. Nguyên tử nguyên tố X có tổng electron ở phân lớp d bằng 6. Vị trí của X trong tuần hoàn các nguyên ố hóa học là
A. ô 24, chu kì 4 nhóm VIB.
B. ô 29, chu kì 4 nhóm IB.
C. ô 26, chu kì 4 nhóm VIIIB.
D. ô 19, chu kì 4 nhóm IA.
Câu 22. Khẳng định nào sau đây không đúng?
A. F là nguyên tố phi kim mạnh nhất.
B. Có thể so sánh tính kim loại giữa hai nguyên tố K và Mg.
C. Kim loại vẫn có khả năng nhận electron để trở thành anion.
D. Các ion O2−, F−, Na+ có cùng số electron.
Câu 23. Cho các dãy nguyên tố mà mỗi nguyên tố được biểu diễn bằng số hiệu nguyên tử tương ứng. Dãy nào sau đây gồm các số hiệu nguyên tử của các nguyên tố thuộc cùng một chu kì trong bảng tuần hoàn?
A. 9, 11, 13.
B. 3, 11, 19.
C. 17, 18, 19.
D. 20, 22, 24.
Câu 24. Nguyên tố có cấu hình electron hóa trị 4d25s2 ở vị trí nào trong bảng tuần hoàn?
A. Chu kì 4, nhóm VB.
B. Chu kì 4, nhóm IIA.
C. Chu kì 5, nhóm IIA.
D. Chu kì 5, nhóm IVB.
Câu 25. Nguyên tử của nguyên tố X khi mất 2 electron lớp ngoài cùng thì tạo thành ion X2+ có cấu hình electron lớp ngoài cùng là 3p6. Số hiệu nguyên tử X là
A. 18.
B. 20.
C. 38.
D. 40.
Câu 26. Cho điện tích hạt nhân O (Z = 8), Na (Z = 11), Mg (Z = 12), Al (Z = 13) và các hạt vi mô: O2-, Al3+, Al, Na, Mg2+, Mg. Dãy nào sau đây được xếp đúng thứ tự bán kính hạt?
A. Al3+2+2-
B. Al3+2+ 2-.
C. Na 3+2+2-.
D. Na 2+ 3+ 2-.
Câu 27. Cation X+ và anion Y2- đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn là:
A. X có số thứ tự 19, chu kì 4, nhóm IA; Y có số thứ tự 17, chu kì 3, nhóm VIIA.
B. X có số thứ tự 19, chu kì 4, nhóm IA; Y có số thứ tự 17, chu kì 3, nhóm VIIA.
C. X có số thứ tự 18, chu kì 3, nhóm VIIIA; Y có số thứ tự 17, chu kì 3, nhóm VIIA.
D. X có số thứ tự 18, chu kì 3, nhóm VIIIA; Y có số thứ tự 16, chu kì 3, nhóm VIA.
Câu 28. Cho 4,104 g một hỗn hợp hai oxit kim loại A2O3 và B2O3 tác dụng vừa đủ với 1 lít dung dịch HCl 0,18M (phản ứng xảy ra hoàn toàn). Dựa vào bảng tuần hoàn, hãy cho biết tên kim loại đó, biết chúng nằm ở hai chu kì 3 hoặc 4 và cách nhau 12 nguyên tố, trong đó một nguyên tố thuộc nhóm IIIA. Kí hiệu hóa học của hai kim loại là
A. Al và Fe
B. Al và Cr
C. Cr và Fe
D. Fe và
II. Tự luận
Bài 1. Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn các nguyên tố hóa học và có tổng số đơn vị điện tích hạt nhân bằng 25.
a) Xác định số hiệu của X, Y.
b) Viết cấu hình electron nguyên tử X, Y và cho biết vị trí X, Y trong bảng tuần hoàn.
Bài 2. Hòa tan hoàn toàn 20 gam hỗn hợp 2 kim loại kiềm thổ A và B thuộc 2 chu kì liên tiếp vào dung dịch HCl dư thu được 15,68 lít khí (đktc). Xác định tên 2 kim loại kiềm thổ và thành phần % về khối lượng của mỗi kim loại trong hỗn hợp.
Đáp án đề kiểm tra giữa kì 1 Hóa 10
I. Trắc nghiệm
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
Đáp án |
D |
D |
A |
B |
D |
D |
A |
D |
A |
C |
C |
B |
C |
D |
|
Câu |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
Đáp án |
B |
C |
D |
C |
D |
B |
C |
C |
D |
D |
B |
A |
B |
A |
Đề thi giữa kì 1 Hóa 10 Kết nối tri thức – Đề 2
Đề thi giữa kì 1 Hóa học 10
|
TRƯỜNG THPT ………… Tổ: Khoa học Tự nhiên – |
ĐỀ KIỂM TRA GIỮA HỌC KỲ I – NĂM HỌC 2023-2024 Môn: Hóa học 10 – Bộ sách: Kết nối tri thức – Thời gian làm bài: 45 phút Đối tượng áp dụng: Chương trình Cơ bản + Chuyên đề học tập |
PHẦN A. TRẮC NGHIỆM (7 điểm)
Anh/chị khoanh tròn vào chữ cái đặt trước câu trả lời đúng ứng với mỗi câu hỏi trắc nghiệm khách quan dưới đây.
Câu 1. Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. Proton.
B. Neutron.
C. Electron.
D. Neutron và electron.
Câu 2. Số N trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối A, số thứ tự của nguyên tố (Z) theo công thức:
A. A = Z – N
B. N = A – Z
C. A = N – Z
D. Z = N + A
Câu 3. Hình ảnh dưới đây mô tả thí nghiệm chứng minh nguyên tử có cấu tạo rỗng. Hiện tượng nào chứng tỏ điều đó?
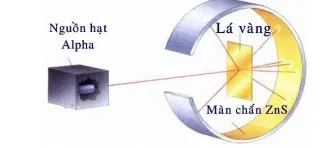
A. Chùm α truyền thẳng.
B. Chùm α bị bật ngược trở lại.
C. Chùm α bị lệch hướng.
D. Chùm α không thể bị xuyên qua.
Câu 4. Khi nói về số khối, điều khẳng định nào sau đây luôn đúng?
Trong nguyên tử, số khối
A. bằng tổng khối lượng các hạt proton và neutron.
B. bằng tổng số các hạt proton và neutron.
C. bằng nguyên tử khối.
D. bằng tổng các hạt proton, neutron và electron.
Câu 5. Nguyên tử của nguyên tố X có tổng số hạt proton, neutron và electron là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
A. 26.
B. 27.
C. 28.
D. 23.
Câu 6. Một nguyên tử có 9 electron ở lớp vỏ, hạt nhân của nó có 10 neutron. Số hiệu nguyên tử đó là
A. 9.
B. 18.
C. 19
D. 28.
Câu 7. Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân.
(2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là +26.
(4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 8. Qui ước lấy amu (hay đvC) làm khối lượng nguyên tử. Một amu có khối lượng bằng:
A.12 khối lượng nguyên tử C.
B. 1,6605.10-27kg.
C. 1,6605.10-25kg.
D. 1,6605.10-25g.
Câu 9. Hạt nhân nguyên tử được tìm ra năm 1911 bằng cách cho hạt α bắn phá một lá vàng mỏng. Thí nghiệm trên được đưa ra đầu tiên do nhà bác học nào say đây?
A. Mendeleep.
B. Chatwick.
C. Rutherfor.
D. Thomson.
Câu 10. Để đo kích thước của hạt nhân, nguyên tử..hay các hệ vi mô khác, người ta không dùng các đơn vị đo phổ biến đối với các hệ vĩ mô như cm, m, km.. mà thường dùng đơn vị đo nanomet (nm) hay angstron (Å). Cách đổi đơn vị đúng là:
a. 1nm= 10–10m.
B. 1 Å=10–9m.
C. 1nm =10–7cm.
D. 1 Å =10nm.
…………..
Đáp án đề thi giữa kì 1 Hóa học 10
PHẦN A. TRẮC NGHIỆM (7 điểm)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
Đáp án |
C |
B |
A |
B |
B |
A |
B |
B |
C |
C |
A |
D |
B |
A |
|
Câu |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
Đáp án |
A |
D |
B |
B |
B |
A |
B |
C |
C |
A |
D |
C |
B |
C |
PHẦN B. TỰ LUẬN (3 điểm)
|
Câu |
Ý |
Nội dung / Hướng dẫn chấm |
Điểm |
|
1 |
Carbon (Z = 6): 1s22s22p2 ⇒ Có 4 electron ở lớp ngoài cùng, là nguyên tố phi kim. |
0,50 |
|
|
Sodium (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron ở lớp ngoài cùng, là nguyên tố kim loại. |
0,50 |
||
|
2 |
a) |
Gọi số khối đồng vị còn lại là . Ta có phương trình Vậy số khối đồng vị còn lại của vanadium là 51 |
0,50 |
|
b) |
Gọi số electron = số proton trong X là Z; số neutron trong X là N. Tổng số proton, electron và neutron trong X là 49 nên (1). |
0,25 |
|
|
Số hạt không mang điện bằng 53,125% số hạt mang điện (2). |
0,25 |
||
|
Từ (1) và (2) ta có Z = 16, N = 17 |
0,50 |
||
|
Nguyên tử nguyên tố X có điện tích hạt nhân là +16; 16 proton; 16 electron; 17 neutron và có số khối . |
0,50 |
…………….
Mời các bạn tải File tài liệu để xem thêm đề kiểm tra giữa kì 1 Hóa 10
