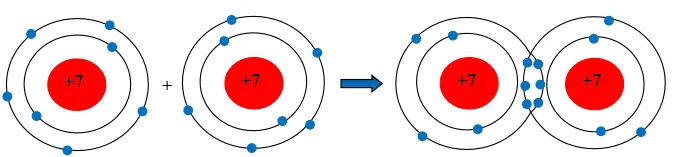
Giải KHTN 7 Bài 5 Cánh diều giúp các bạn học sinh lớp 7 có thêm nhiều gợi ý tham khảo để trả lời các câu hỏi nội dung bài học Giới thiệu về liên kết hóa học.
Bạn đang đọc: KHTN Lớp 7 Bài 5: Giới thiệu về liên kết hóa học
Soạn KHTN 7 Cánh diều Bài 5 được biên soạn với các lời giải chi tiết, đầy đủ và chính xác bám sát chương trình SGK. Hi vọng đây sẽ là tài liệu cực kì hữu ích hỗ trợ các em học sinh lớp 7 trong quá trình giải bài tập. Đồng thời phụ huynh có thể sử dụng để hướng dẫn con em học tập và đổi mới phương pháp giải phù hợp hơn. Vậy sau đây là Soạn Khoa học tự nhiên 7 Cánh diều Bài 5 Cánh diều mời các bạn theo dõi nhé.
KHTN Lớp 7 Bài 5: Giới thiệu về liên kết hóa học
I. Câu hỏi Mở đầu KHTN 7 Cánh diều Bài 5
Trong điều kiện thường, nguyên tử của các nguyên tố khí hiếm tồn tại độc lập vì có lớp electron ngoài cùng bền vững. Nguyên tử của các nguyên tố khác luôn có xu hướng tham gia liên kết để có được lớp electron ngoài cùng bền vững tương tự khí hiếm. Vậy liên kết giữa các nguyên tử được hình thành như thế nào?
Trong điều kiện thường, nguyên tử của các nguyên tố khí hiếm tồn tại độc lập vì có lớp electron
Trả lời:
Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. Vì vậy, các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
Nguyên tử của các nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác.
II. Trả lời câu hỏi thảo luận KHTN 7 Bài 5 sách Cánh diều
Câu 1
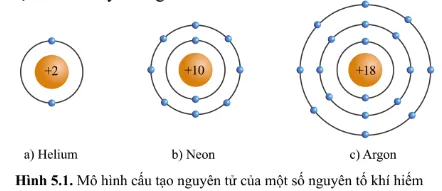
Quan sát hình 5.1, hãy cho biết số electron ở lớp ngoài cùng của vỏ nguyên tử khí hiếm.
Gợi ý đáp án
Hình a) nguyên tử Helium có 2 electron lớp ngoài cùng.
Hình b) nguyên tử Neon có 8 electron lớp ngoài cùng.
Hình c) nguyên tử Argon có 8 electron lớp ngoài cùng.
Nhận xét: Lớp vỏ ngoài cùng của các nguyên tử khí hiếm đều có 8 electron (riêng He có 2 electron).
Câu 2
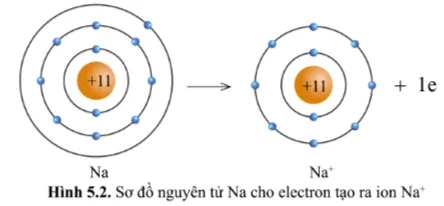
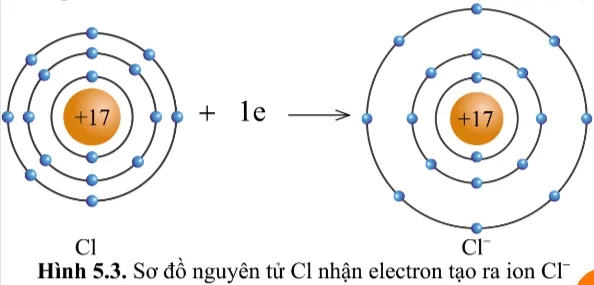
Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào?
Gợi ý đáp án
Lớp vỏ của ion Na+ có 10 electron tương tự lớp vỏ nguyên tử của nguyên tố khí hiếm Neon (hình 5.1b)
Lớp vỏ của ion Cl- có 18 electron tương tự lớp vỏ nguyên tử của nguyên tố khí hiếm Argon (hình 5.1c)
Câu 3
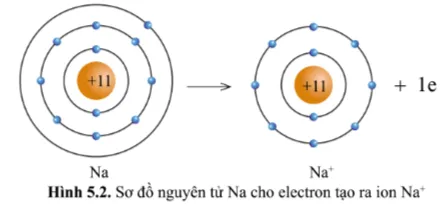
Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+.
Gợi ý đáp án
Ion Na+ ít hơn 1 eletron so với nguyên tử Na .
Ion Na+ ít hơn một lớp electron so với nguyên tử Na .
Có thể nói nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương, kí hiệu là Na+.
Câu 4
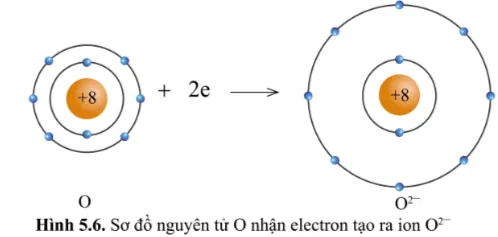
Quan sát các hình 5.5 và 5.6 cho biết các ion Mg2+ và O2- có lớp vỏ tương tự khí hiếm nào.
Gợi ý đáp án
Ion Mg2+ lớp vỏ có 10 electron tương tự như khí hiếm Neon (xem lại hình 5.1b)
Ion O2- lớp vỏ có 10 electron tương tự như khí hiếm Neon (xem lại hình 5.1b)
Câu 5
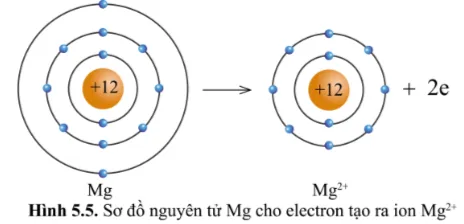
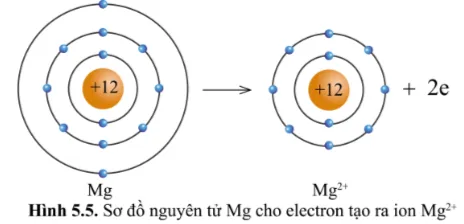
Quan sát hình 5.5, hãy so sánh về số electron, số lớp electron giữa nguyên tử Mg và ion Mg2+.
Gợi ý đáp án
Ion Mg2+ có ít hơn 2 electron so với nguyên tử Mg
Ion Mg2+ có ít hơn một lớp electron so nguyên tử Mg .
Nhận xét: Nguyên tử Mg cho đi 2 electron lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu là Mg2+.
Câu 6
Quan sát hình 5.9, hãy cho biết nguyên tử H trong phân tử hydrogen có lớp vỏ tương tự khí hiếm nào.
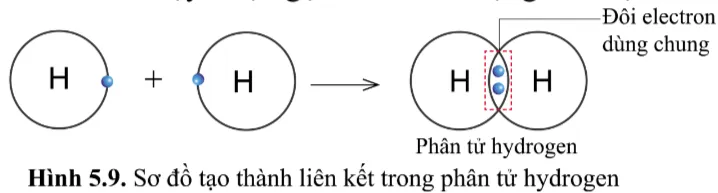
Gợi ý đáp án
Trong phân tử hydrogen gồm hai nguyên tử H, mỗi nguyên tử H có 2 electron ở lớp vỏ.
Giống với lớp vỏ của khí hiếm Helium (xem lại hình 5.1a)
Câu 7
Quan sát hình 5.10, cho biết trong phân tử nước, mỗi nguyên tử H và O có bao nhiêu electron ở lớp ngoài cùng.
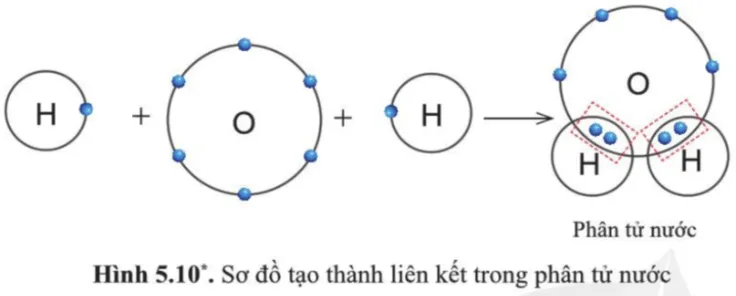
Gợi ý đáp án
Trong phân tử nước, nguyên tử O có 8 electron lớp ngoài cùng tương tự như khí hiếm.
Mỗi nguyên tử H có 2 electron lớp ngoài cùng tương tự như khí hiếm helium
Câu 8
Quan sát hình 5.11, hãy cho biết trong phân tử khí carbonic nguyên tử C có bao nhiêu electron dùng chung với nguyên tử O.
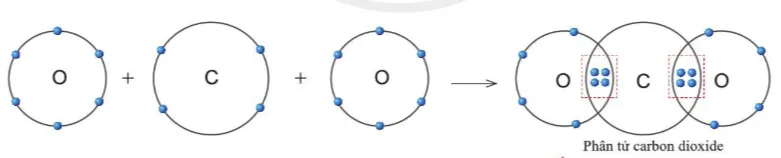
Gợi ý đáp án
Trong phân tử khí carbonic, nguyên tử C có 4 electron dùng chung với nguyên tử O (mỗi nguyên tử O góp 2 electron).
III. Giải phần Luyện tập KHTN 7 Cánh diều Bài 5
Luyện tập 1
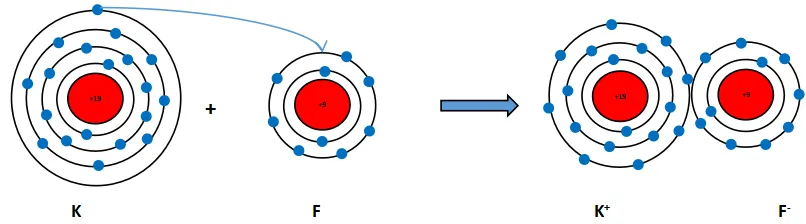
Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K kết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride.
Gợi ý đáp án
Khi K kết hợp với F để tạo thành phân tử potassium fluoride sẽ diễn ra cho và nhận electron giữa hai nguyên tử như sau:
+ Nguyên tử K cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là K+.
+ Nguyên tử F nhận 1 electron từ nguyên tử K trở thành ion mang một điện tích âm, kí hiệu là F-.
Các ion K+ và F- hút nhau tạo thành liên kết trong phân tử sodium chloride.
Luyện tập 2
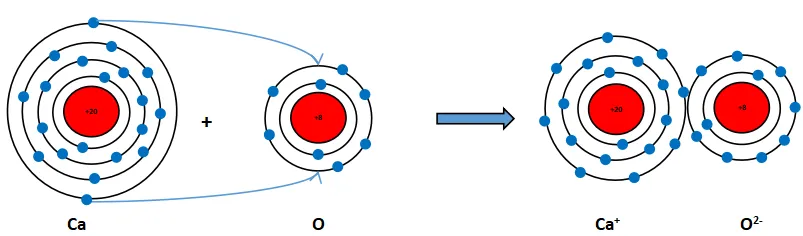
Nguyên tử Ca có 2 electron ở lớp ngoài cùng. Hãy vẽ sơ đồ tạo thành liên kết khi nguyên tử Ca kết hợp với nguyên tử O khi nguyên tử Ca kết hợp với nguyên tử O tạo ra phân tử calcium oxide.
Gợi ý đáp án
Khi Ca kết hợp với O tạo thành phân tử calcium oxide sẽ diễn ra sự cho và nhận electron giữa hai nguyên tử như sau:
+ Nguyên tử Ca cho đi 2 electron lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu là Ca2+.
+ Nguyên tử O nhận 2 electron từ nguyên tử Ca tạo thành ion mang điện tích âm kí hiệu là O2-.
Các ion Ca2+ và O2- hút nhau tạo thành liên kết trong phân tử calcium oxide.
Luyện tập 3
Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Theo em, ở điều kiện thường, potassium chloride là chất rắn, chất lỏng hay chất khí? Vì sao?
Gợi ý đáp án
Ở điều kiện thường, potassium chloride là chất rắn vì:
Khi nguyên tử K (kim loại điển hình) kết hợp với nguyên tử Cl (phi kim điển hình) thì kim loại K sẽ cho electron tạo thành ion dương, nguyên tử Cl sẽ nhận electron tạo thành ion âm. Các ion dương và ion âm hút nhau tạo ra hợp chất ion là potassium chloride.
Các hợp chất ion đều là chất rắn ở điều kiện thường.
Luyện tập 4
Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine.
a) Mỗi nguyên tử Cl cần thêm bao nhiêu electron vào lớp ngoài cùng để có lớp vỏ tương tự khí hiếm?
b) Hãy vẽ sơ đồ tạo thành liên kết trong phân tử chlorine.
Gợi ý đáp án
a)
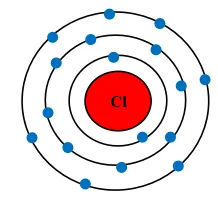
Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
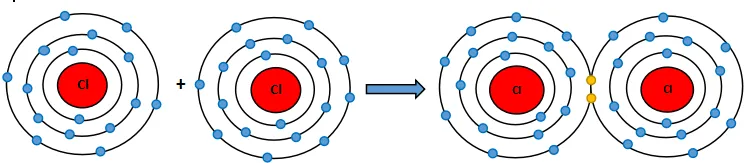
b) Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
Luyện tập 5
Mỗi nguyên tử H kết hợp với một nguyên tử Cl tạo thành phân tử hydrogen chloride. Hãy vẽ sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và nguyên tử Cl.
Gợi ý đáp án
Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi nguyên tử H kết hợp với nguyên tử Cl, nguyên tử Cl góp 1 electron, nguyên tử H góp 1 electron. Như vậy giữa nguyên tử H và nguyên tử Cl có 1 đôi electron dùng chung. Hạt nhân nguyên tử H và Cl cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử hydrogen chloride.
Luyện tập 6
Mỗi nguyên tử N kết hợp với 3 nguyên tử H tạo thành phân tử ammonia. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử ammonia.
Gợi ý đáp án
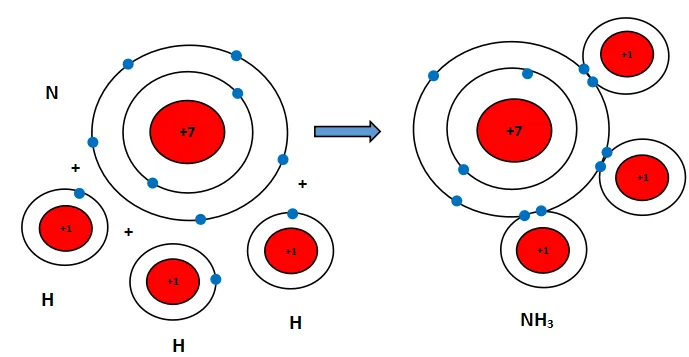
Nguyên tử N có 7 electron, trong đó có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi N kết hợp với H, nguyên tử N góp 3 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử N và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử N và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử ammonia.
Luyện tập 7
Hai nguyên tử N kết hợp với nhau tạo thành phân tử nitrogen. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử nitrogen.
Gợi ý đáp án
Nguyên tử N có 7 electron, trong đó có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi hai nguyên tử N liên kết với nhau, mỗi nguyên tử góp chung 3 electron để tạo ra 3 cặp electron dùng chung. Hạt nhân của hai nguyên tử N cùng hút các đôi electron dùng chung và liên kết với nhau tạo thành phân tử nitrogen.