Kim loại tác dụng với muối là tài liệu vô cùng hữu ích mà Download.vn muốn giới thiệu đến quý thầy cô cùng các bạn học sinh lớp 12 tham khảo.
Bạn đang đọc: Bài tập kim loại tác dụng với muối
Bài tập kim loại tác dụng với muối tổng hợp kiến thức về phương pháp giải, ví dụ minh họa kèm theo một số câu hỏi trắc nghiệm có đáp án chi tiết. Thông qua tài liệu này các bạn lớp 12 có thêm nhiều tư liệu tham khảo, nắm vững kiến thức về kim loại tác dụng với muối để giải nhanh các bài tập Hóa 12. Chúc các bạn học tốt.
Bài tập kim loại tác dụng với muối
I. Phương pháp giải bài tập kim loại tác dụng với muối
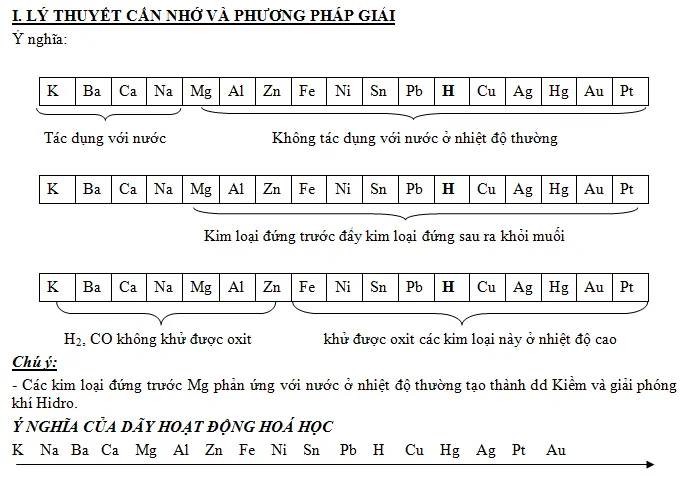
Dãy được sắp xếp theo chiều giảm dần tính hoạt động hoá học (từ trái sang phải)
- Một số kim loại vừa tác dụng được với axit và với nước: K, Na, Ba, Ca
- Kim loại + H2O → Dung dịch bazơ + H2
- Kim loại vừa tác dụng với axit, vừa tác dụng với bazơ: (Be), Al, Zn, Cr
2A + 2(4 – n)NaOH + 2(n – 2)H2O → 2Na4 – nAO2 + nH2
Ví dụ:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
Zn + 2NaOH → Na2ZnO2 + H2
Zn + Ba(OH)2 → BaZnO2 + H2
– Kim loại đứng trước H tác dụng với dung dịch axit HCl, H2SO4 loãng tạo muối và giải phóng H2.
Kim loại + Axit → Muối + H2
Lưu ý: Kim loại trong muối có hoá trị thấp (đối với kim loại đa hoá trị)
Kể từ Mg trở đi kim loại đứng trước đẩy được kim loại đứng sau ra khỏi muối của chúng. theo quy tắc:
Chất khử mạnh + chất oxi hóa mạnh → chất oxi hoá yếu + chất khử yếu.
Lưu ý: những kim loại đầu dãy (kim loại tác dụng được với nước) thì không tuân theo quy tắc trên mà nó xảy ra theo các bước sau:
Kim loại kiềm (hoặc kiềm thổ) + H2O → Dung dịch bazơ + H2
Sau đó:
Dung dịch bazơ + dung dịch → muối Muối mới + Bazơ mới (*)
Điều kiện(*): Chất tạo thành phải có ít nhất 1 chất kết tủa (không tan).
Ví dụ: Cho Ba vào dung dịch CuSO4
Đầu tiên:
Ba + 2H2O → Ba(OH)2 + H2
Sau đó:
Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2
Đặc biệt:
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
Một số lưu ý
– Đối với bài tập một kim loại tác dụng với dung dịch gồm nhiều muối thì kim loại sẽ tác dụng với muối có chứa ion kim loại có tính oxi hóa mạnh hơn trước. nếu sau phản ứng này, kim loại còn dư mới tiếp tục xảy ra phản ứng với muối còn lại.
Chẳng hạn: cho Fe vào dung dịch gồm AgNO3 và Cu(NO3 )2, thì Fe sẽ tác dụng với dung dịch AgNO3 trước, sau đó nếu Fe dư thì mới xảy ra tiếp phản ứng Fe tác dụng với dung dịch muối Cu(NO3)2.
– Đối với bài tập hỗn hợp kim loại tác dụng với dung dịch gồm nhiều muối nếu làm thông thường sẽ phải xét nhiều trường hợp.
Chẳng hạn: Cho Fe, Al tác dụng với dung dịch gồm AgNO3 và Cu(NO3)2. Đầu tiên kim loại mạnh hơn sẽ tác dụng với muối có chứa ion kim loại có tính oxi hóa mạnh hơn.
Al + 3Ag+ → Al3+ + 3Ag (1)
Sau phản ứng (1) nếu Ag dư:
2Al + 3Cu2+ → 2Al3+ + 3Cu (2)
Sau phản ứng (2) nếu Cu2+ dư:
Fe + Cu2+ → Cu + Fe2+ (3)
Cách làm nhanh: dùng bảo toàn electron sẽ tránh được việc phải xét nhiều trường hợp.
II. Ví dụ minh họa kim loại tác dụng với muối
Bài 1. Cho 3,36 gam Fe phản ứng với 62,5 ml dung dịch HNO3 3,2M thu được dung dịch X và khí NO (sản phẩm khử duy nhất của N+5). Biết các phản ứng xảy ra hoàn toàn, khối lượng muối trong dung dịch X là
Gợi ý đáp án
nFe = 0,06 mol;
nHNO3 = 0,065.3,2 = 0,2 mol
Giả sử tạo thành 2 muối Fe(NO3)2 x mol và Fe(NO3)3 y mol
Bảo toàn nguyên tố Fe:
nFe = nFe(NO3)2 + nFe(NO3)3 => x + y = 0,06 (1)
Ta có: nHNO3 = 4nNO => nNO = 0,2/4 = 0,05 mol
Bảo toàn e: 2nFe(NO3)2 + 3nFe(NO3)3 = 3nNO
=> 2x + 3y = 0,05.3 (2)
Từ (1) và (2) => x = 0,03 và y = 0,03 mol
=> mmuối= mFe(NO3)2 + mFe(NO3)3 = 12,66 gam
Bài 2. Cho thanh sắt Fe vào dung dịch X chứa 17 gam AgNO3 và 37,6 gam Cu(NO3)2. Khi thấy thanh kim loại tăng lên 8,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
Gợi ý đáp án
nAgNO3 = nAg+ = 0,1 mol;
nCu(NO3)2 = nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1
=> mtăng = 0,1.108 – 0,05.56 = 8
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
a → a → a
=> mtăng = 64a – 56a = 8a
=> Tổng khối lượng tăng ở 2 phản ứng là:
mtăng = 8 + 8a = 8,8 => a = 0,1 mol
=> mkim loại bám vào = mAg + mCu = 17,2 gam
Bài 3. Cho m gam Mg vào 200 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 51,6 gam chất rắn. Giá trị của m là
Gợi ý đáp án
nAl2(SO4)3 = 0,2 mol => nAl3+ = 0,4 mol
nCuSO4 = 0,6 mol => nCu2+ = 0,6 mol
Ban đầu: phản ứng vừa đủ với Cu2+ => m1 = 0,6.64 = 38,4 gam
Tiếp theo: Phản ứng với Cu2+ và Al3+ => m2 = 0,6.64 + 0,4.27 = 49,2
=> cả Cu2+ và Al3+ phản ứng hết, Mg dư
=> chất rắn sau phản ứng gồm Cu (0,6 mol), Al (0,4 mol) và Mg
=> mMg dư= 51,6 – 49,2 = 2,4 gam
Bảo toàn e: 2nMg phản ứng= 3nAl+ 2nCu
=> nMg phản ứng = (3.0,4 + 0,6.2) / 2 = 1,2 mol
=> m = 1,2.24 + 2,4 = 31,2 gam
Bài 4: Cho 0,774 gam hỗn hợp Zn và Cu vào 500 ml dung dịch AgNO3 nồng độ 0,04M. Sau khi các phản ứng xảy ra hoàn toàn được chất rắn X nặng 2,288 gam chất rắn. Hãy xác định thành phần của?
Gợi ý đáp án
Ta có: = 0,5.0,04 = 0,02(mol)
Thứ tự phản ứng:
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag (1)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (2)
Nếu Zn, Cu phản ứng hết thì khối lượng kim loại thu được tối đa nặng:
108 . 0,02 = 2,16 (gam) X ⇒ kim loại còn dư ⇒ AgNO3 phản ứng hết.
Nếu Cu chưa phản ứng thì phản ứng (1) làm tăng một lượng:
108.0,02 – 65.0,02/2 = 1,51 (gam) tức khối lượng chất rắn lúc đó nặng:
0,774 + 1,51 = 2,284 (gam) X ⇒ Cu có phản ứng nhưng còn dư.
Vậy X gồm Ag và Cu.
Bài 5. Có 200ml hỗn hợp dung dịch gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Thêm 2,24g bột Fe kim loại vào dung dịch đó khuấy đều tới phản ứng hoàn toàn thu được chất rắn A và dung dịch B.
a/ Tính số gam chất rắn A.
b/ Tính nồng độ mol/lit của các muối trong dung dịch B, biết rằng thể tích dung dịch không đổi
Gợi ý đáp án
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (2)
Số mol của các chất là: n
nFe = 0,04 mol; nAgNO3 = 0,02 mol; nCu(NO3)2 = 0,1 mol
Vì Ag hoạt động hoá học yếu hơn Cu nên muối của kim loại Ag sẽ tham gia phản ứng với Fe trước.
Theo pứ (1): nFe (p ) = 0,01 mol; Vậy sau phản ứng (1) thì nFe còn lại = 0,03 mol.
Theo (pứ ( 2 ): ta có nCu(NO3)2 pứ = nFe còn dư = 0,03 mol.
Vậy sau pứ (2): nCu(NO3)2 còn dư là = 0,1 – 0,03 = 0,07 mol
Chất rắn A gồm Ag và Cu
mA = 0,02 . 108 + 0,03 . 64 = 4,08 g
dung dịch B gồm: 0,04 mol Fe(NO3)2 và 0,07 mol Cu(NO3)2 còn dư.
Thể tích dung dịch không thay đổi V = 0,2 lit
Vậy nồng độ mol/lit của dung dịch sau cùng là:
CM [ Cu(NO3)2] dư = 0,35M ; CM [ Fe(NO3)2] = 0,2M
Bài 6. Cho 1 gam kim loại R vào 200 ml dung dịch AgNO3 0,25M đến khi phản ứng hoàn toàn thu được dung dịch không chứa ion Ag+ và có khối lượng giảm so với khối lượng của dung dịch AgNO3 ban đầu là 4,4 gam. Kim loại R là?
A. Cu.
B. Ca.
C. Zn.
D. Fe.
Gợi ý đáp án
*Trường hợp 1: R (hóa trị n) phản ứng trực tiếp với AgNO3
Phương trình phản ứng:
R + nAgNO3→ R(NO3)n + nAg
0,05/n → 0,05 → 0,05 mol
mdd giảm= mAg– mR pứ= 0,05.108 – 0,05R/n= 4,4
→ R/n= 20 → Loại
*Trường hợp 2: R là Ca
Ca + H2O → Ca(OH)2+ H2
0,025 → 0,025 → 0,025 mol
Ca(OH)2 + 2AgNO3→ Ca(NO3)2+ 2AgOH ↓
0,025 → 0,05 → 0,05
2AgOH → Ag2O + H2O
0,05 → 0,025 mol
ndd giảm= mAg2O+ mH2 – mCa= 0,025.232 + 0,025.2 – 1= 4,85 gam: Loại
*Vậy R là Fe.
2.nFeAgNO3 Fe → Fe tan hết, Ag+ chuyển hết thành Ag
mdd giảm= mAg– mFe= 0,05.108 – 1= 4,4 gam
Bài 7: Cho 2,24 gam bột Fe vào 200 ml dung dịch hỗn hợp gồm có AgNO3 0,1M và Cu(NO3)2 0,5M, khuấy đều tới phản ứng hoàn toàn, thu được chất rắn A và dung dịch B.
a) Tính số gam chất rắn A.
b) Tính nồng độ mol của các chất trong dung dịch B.
Gợi ý đáp án
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
0,01 0,02 0,01 0,02 (mol)
Fe + Cu(NO3)2 → Cu + Fe(NO3)2 (2)
0,03 0,03 0,03 0,03 (mol)
= 0,02 (mol); nFe = 0,04 (mol);
= 0,1(mol)
nFe phản ứng (1) = 0,01(mol); nFe pư (2) = 0,04 – 0,01 = 0,03 (mol)
dư = 0,1 – 0,03 = 0,07 (mol)
Chất rắn A gồm: 0,02 mol Ag và 0,03 mol Cu
⇒ mA = 0,02.108 + 0,03.64 = 4,08(gam)
Dung dịch B: Fe(NO3)2: 0,04 (mol) ⇒ CM = 0,2 M
Cu(NO3)2: 0,07 (mol) ⇒ CM = 0,35M
III. Trắc nghiệm kim loại tác dụng với muối
Bài 1: Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Vậy khối lượng của vật sau phản ứng là:
A. 10,5g
B. 10,76g
C. 11,2g
D. 12,8g
Đáp án: B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng vật bằng Cu = 10 – 0,005.64 + 0,01.108 = 10,76 (g)
Bài 2: Nhúng một đinh sắt vào 200ml dung dịch CuSO4 1M. Sau một thời gian lấy đinh sắt ra, sấy khô và đem cân thì thấy khối lượng đinh sắt tăng lên 0,4g. Xem như thể tích dung dịch thay đổi không đáng kể. Vậy nồng độ của CuSO4 còn lại sau phản ứng là:
A. 0,75M
B. 0,5M
C. 0,65M
D. 0,8M
Đáp án: C
Số mol CuSO4 ban đầu là 0,2 mol
Gọi a là số mol Fe phản ứng:
Fe + CuSO4 → FeSO4 + Cu
a a a
56a (g) 64a (g)
Khối lượng định sắt tăng lên là: 64a – 56a = 8a
Ta có: 8a = 0,4 → a = 0,05 mol
Số mol CuSO4 dư = 0,2 – 0,05 = 0,15 mol → [CuSO4] = 0,75M
Bài 3: Ngâm một lá Zn trong dung dịch có hòa tan 8,32 gam CdSO4. Phản ứng xong thấy khối lượng là Zn tăng 2,35%. Vậy khối lượng của là Zn trước khi tham gia phản ứng là:
A. 60g
B. 70g
C. 80g
D. 85g
Đáp án: C
Số mol CdSO4 = 8,32/208 = 0,04 (mol)
Zn + CdSO4 → ZnSO4 + Cd ↓
65 gam 112 gam
65.0,04 112.0,04
Khối lượng lá Zn tăng: 112.0,4 – 65.0,04 = 1,88 (g)
⇒ Khối lượng lá Zn trước khi phản ứng: 1,88.100/2,35 = 80 (g)
Bài 4: Ngâm một lá kẽm trong dung dịch chứa 2,24 gam ion kim loại M2+ trong muối sunfat sau phản ứng, khối lượng lá Zn tăng lên 0,94 gam. Vậy M là:
A. Pb
B. Cu
C. Fe
D. Cd
Đáp án: D
Phương trình phản ứng:
Zn + M2+ → Zn2+ + M
65 gam M gam
65a 2,24
Khối lượng lá Zn tăng: 2,24 – 65a = 0,94 → a = 0,02 mol
M = 2,24/0,02 = 112 → M là Cd
Bài 5: Lấy hai thanh kim loại M đều có giá trị là 1g. Nhúng thanh thứ nhất vào dung dịch AgNO3 và thanh thứ hai vào dung dịch Cu(NO3)2. Sau một thời gian khối lượng thanh thứ nhất tăng 151%, thanh thứ hia giảm 1% (so với ban đầu). Biết rằng số mol M phản ứng ở hia thanh là như nhau. Vậy M là:
A. Cd
B. Fe
C. Zn
D. Cu
Đáp án: C
Phương trình phản ứng:
M + nAgNO3 → M(NO3)n + nAg
a an (mol)
aM 108an
Khối lượng thanh thứ nhất tăng 151%:
108an – aM = 1,51 (1)
2M + nCu(NO3)2 → 2M(NO3)n + nCu
a 0,5an (mol)
aM 32an
Khối lượng thanh thứ 2 giảm:
aM – 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
⇒ Chọn M = 32,5n
Khi n = 2 thì M = 65
Vậy M = Zn
Bài 6: Cho 0,01 mol Fe vào 50ml dung dịch AgNO3 1M khi phản ứng kết thúc khối lượng Ag thu được là:
A. 3,6
B. 3,24
C. 2,16
D. 1,08
Đáp án: B
nAg+ = 0,05.1 = 0,05 mol
Fe + 3Ag+ → Fe3+ + 3Ag
0,01 0,03 → 0,03
=> nAg+ dư → nAg = 3nFe = 0,03 mol
=> mAg = 3,24 gam
Bài 7: Hòa tan 3 gam một hợp kim Cu-Ag trong dung dịch HNO3 tạo ra được 7,34 gam hỗn hợp gồm 2 muối Cu(NO3)2 và AgNO3. Vậy thành phần % của Cu và Ag trong hợp kim là:
A. 60% và 40%
B. 64% và 36%
C. 70% và 30%
D. 55% và 45%
Đáp án: B
Sơ đồ chuyển hóa sau:
Cu → Cu(NO3)2
Ag → AgNO3
Ta lập được hệ gồm 2 phương trình:
Giải ra được: x = 0,03, y = 0,01 → %Cu = 64%
Bài 8: Ngâm một lá kẽm vào dung dịch chứa 2,24 gam ion kim loại M2+. Phản ứng xong, khối lượng lá Zn tăng thêm 0,94 gam. M2+ là ion kim loại nào sau đây?
A. Sn2+
B. Cu2+
C. Pb2+
D. Cd2+
Đáp án:D
Chọn D
Phản ứng:
Zn + M2+ → Zn2+ + M
x x x x (mol)
Vì khối lượng thanh kẽm tăng nên áp dụng phương trình đại số sau:
M.x – 65x = 0,94 (1)
Và x = nM2+ = 2,24/M (2)
Từ (1) và (2) => 2,24/M.(M-65) = 0,94
⇒ 2,24M – 145,6 = 0,94M ⇔ 1,3M = 145,6 ⇒ M = 112 : cađimin (Cd)
Bài 9. Cho m gam bột Zn vào 500 ml dung dịch Fe2(SO4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 9,6 gam so với khối lượng dung dịch ban đầu. Giá trị của m là
A. 29,25.
B. 48,75.
C. 32,50.
D. 20,80.
Gợi ý đáp án
nFe2(SO4)3= 0,24.0,5 = 0,12mol
nFe3+= 0,24
Zn + 2Fe3+ → Zn2+ + 2Fe2+
0,12….0,24…………….0,24
Zn + Fe2+ → Zn2+ + Fe
x……………………x
→ mdd tăng= mZn – mFe= 65(0,12 + x) – 56x = 9,6 → x = 0,2
=> nZn ban đầu = 0,12 + 0,2 = 0,23 mol => mZn= 0,32.65 = 28,8 gam
Bài 10. Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol 1 : 2) vào nước (dư) được dung dịch X. Cho dung dịch AgNO3 (dư) vào X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 28,7
B. 68,2
C. 57,4
D. 21,8
Gợi ý đáp án
Gọi số mol của FeCl2 là x
Theo đề bài ta có: 127x + 58,5.2.x = 24,4 => x = 0,1.
FeCl2 + 2AgNO3→ 2AgCl + Fe(NO3)2
0,1——> 0,2——–> 0,2——-> 0,1 mol
NaCl + AgNO3 → AgCl + NaNO3
0,2——-> 0,2——> 0,2
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
0,1———————————> 0,1
m = (0,2 + 0,2).143,5 + 108.0,1 = 68,2 (g)

