Bộ đề thi giữa kì 2 Hóa học 10 năm 2023 – 2024 gồm 7 đề có đáp án chi tiết kèm theo bảng ma trận đề thi. Đề kiểm tra giữa kì 2 Hóa học lớp 10 được áp dụng với cả 3 bộ sách Kết nối tri thức, Chân trời sáng tạo và sách Cánh diều.
Bạn đang đọc: Bộ đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2023 – 2024 (Sách mới)
Đề kiểm tra giữa kì 2 Hóa học 10 năm 2023 giúp các bạn học sinh nhanh chóng làm quen với cấu trúc đề thi, ôn tập để đạt được kết quả cao trong kì thi giữa học kì sắp tới. Đồng thời cũng là tài liệu tham khảo dành cho quý thầy cô ra đề thi cho các em học sinh của mình. Vậy sau đây là TOP 7 đề kiểm tra Hóa học 10 giữa kì 2 năm 2023 – 2024 sách mới, mời các bạn cùng theo dõi tại đây. Bên cạnh đó các bạn xem thêm: bộ đề thi giữa kì 2 môn Ngữ văn 10.
Bộ đề thi giữa kì 2 môn Hóa học 10 năm 2023 – 2024 (Có đáp án)
1. Đề thi giữa học kì 2 môn Hóa học 10 Kết nối tri thức
1.1 Đề kiểm tra giữa kì 2 Hóa học 10
Khoanh vào chữ cái đặt trước câu trả lời đúng (0,25 điểm)
Câu 1. O2 bị lẫn một ít tạp chất Cl2. Chất tốt nhất để loại bỏ Cl2 là?
| A. KOH. | B. H2O. | C. SO2. | D. H2 |
Câu 2. Điều chế clorua vôi bằng cách đun nóng nhẹ (ở 30oC ) cặp chất nào sau đây
A. Ca(OH)2 với Cl2
B. Ca(OH)2 với HCl
C. CaO với HCl
D. CaO với Cl2
Câu 3. Chọn câu trả lời không đúng trong các câu dưới đây.
A. Axit HF có thể tác dụng được với SiO2
B. Flo là chất khí rất độc
C. Flo là chất khí màu nâu đỏ
D. Flo phản ứng trực tiếp với hầu hết kim loại
Câu 4. Lớp ngoài cùng của các nguyên tố halogen có đặc điểm gì chung?
A. Có 6 electron
B. Có 5 electron
C. Có 7 electron
D. Có 4 electron
Câu 5. Trường hợp nào sau đây không xảy ra phản ứng?
A. NaF + AgNO3
B. NaBr + AgNO3
C. NaI + AgNO3
D. NaCl + AgNO3
Câu 6. Hoà tan hoàn toàn 12,08 gam hỗn hợp Mg, Al, Zn trong dung dịch HCl dư thu được 13,44 lít khí (đktc) và m gam muối. Giá trị của m là
| A. 46,42 | B. 47,02 | C. 53,48 | D. 54,68 |
Câu 7. Phản ứng nào sau đây chứng tỏ HCl có tính oxi hóa?
A. NaOH + HCl → NaCl + H2O
B. Al2O3 + 6HCl → 2AlCl3 + 3H2O
C. Fe + 2HCl → FeCl2 + H2
D. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Câu 8. Sắt tác dụng với chất nào sau đây cho muối sắt (III) clorua?
| A. Cl2 | B. CuCl2 | C. NaCl | D. HCl |
Câu 9. Phát biểu nào sau đây là sai?
A. Các halogen có tính chất hóa học gần giống nhau
B. Trong hợp chất, các halogen đều có thể có số oxi hóa: -1; +1; +3; +5; +7
C. Khả năng oxi hóa của halogen giảm dần từ flo đến iot
D. Halogen là những chất oxi hóa mạnh
Câu 10. Tính khử của các halogenua giảm dần theo thứ tự sau
A. F– > Cl– > Br– > I–
B. I– > Cl– > Br– > F–
C. I– > Br– > Cl– > F–
D. Cl– > F– > I– > Br–
Câu 11. Cho 0,2 mol SO2 tác dụng với 0,3 mol NaOH. Sau phản ứng thu được m gam muối. Giá trị m?
| A. 18,9g | B. 23g | C. 20,8g | D. 24,8g |
Câu 12. Cách tốt nhất để làm sạch không khí trong phòng thí nghiệm có lẫn lượng lớn khí clo là
A. phun khí hiđro
B. phun nước
C. phun dung dịch nước vôi trong
D. phun dung dịch amoniac
Câu 13. Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng
B. điện phân nóng chảy NaCl
C. điện phân dung dịch NaCl có màng ngăn
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl
Câu 14. Khí H2S không tác dụng với chất nào sau đây?
A. Dung dịch CuCl2.
B. Khí Cl2.
C. Dung dịch KOH.
D. Dung dịch FeCl2.
Câu 15. Có 3 dung dịch sau: NaOH, HCl ,H2SO4 loãng. Thuốc thử duy nhất để phân biệt 3 dung dịch là
| A. NaCl | B. BaCO3 | C. Ba(OH)2 | D. AgNO3 |
Câu 16. Tính số mol KMnO4 và số mol HCl cần lấy để điều chế được một lượng khí Cl2 phản ứng vừa đủ với 14 gam Fe.
A. 0,15 mol và 1,20 mol
B. 0,30 mol và 2,40 mol
C. 0,20 mol và 1,40 mol
D. 0,075 mol và 0,60 mol
Câu 17. Dẫn 2,24 lít khí clo (đktc) vào 200 gam dung dịch NaOH 40%. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Biết hiệu suất 100%, m có giá trị là
| A. 83,5 | B. 13,3 | C. 85,3 | D. 77,85 |
Câu 18. Đốt cháy sắt trong khí clo, người ta thu được 32,5 gam muối. Thể tích khí clo (đktc) đã tham gia phản ứng là
| A. 6,72 lít. | B. 13,44 lít. | C. 4,48 lít. | D. 2,24 lít. |
Câu 19. Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
A. KNO3, CaCO3, Fe(OH)3
B. NaHCO3, AgNO3, CuO
C. FeS, BaSO4, KOH
D. AgNO3, (NH4)2CO3, CuS
Câu 20. Dãy nào được xếp đúng thứ tự tính axit giảm dần?
A. HClO, HClO3, HClO2, HClO4.
B. HClO4, HClO3, HClO2, HClO.
C. HClO, HClO2, HClO3, HClO4.
D. HClO4, HClO2, HClO3, HClO.
Câu 21. Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là
A. CaOCl2
B. KMnO4
C. K2Cr2O7
D. MnO2
Câu 22. Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị II không đổi trong hợp chất) trong khí Cl2 dư, thu được 28,5 gam muối. Kim loại M là
| A. Be | B. Cu | C. Ca | D. Mg |
Câu 23. Trong các chất sau: FeCl2, FeCl3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3. Số chất có cả tính oxi hoá và tính khử là
| A. 5 | B. 3 | C. 2 | D. 4 |
Câu 24. X là dung dịch HCl nồng độ x mol/l. Y là dung dịch Na2CO3 nồng độ y mol/l. nhỏ từ từ 100 ml X vào 100 ml Y, sau các phản ứng thu được V1 lít CO2 (đktc). Nhỏ từ từ 100 ml Y vào 100 ml X, sau phản ứng thu được V2 lít CO2 (đktc). Biết tỉ lệ V1:V2 = 4:7. Tỉ lệ x:y bằng:
| A. 11:4 | B. 11:7 | C. 7:5 | D. 7:3 |
Câu 25. Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZXY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Thành phần phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
| A. 47,2 % | B. 52,8% | C. 58,2% | D. 41,8% |
1.2 Đáp án đề thi giữa kì 2 Hóa học 10
| 1A | 2A | 3D | 4C | 5A |
| 6D | 7C | 8A | 9B | 10C |
| 11B | 12D | 13A | 14D | 15B |
| 16A | 17C | 18A | 19B | 20C |
| 21C | 22D | 23A | 24C | 25D |
2. Đề thi giữa kì 2 Hóa 10 Chân trời sáng tạo
2.1 Đề kiểm tra giữa học kì 2 Hóa học 10
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Oxi là nguyên tố phi kim hoạt động, có tính oxi hóa mạnh là do
A. Oxi có nhiều trong tự nhiên.
B. Oxi có độ âm điện lớn.
C. Oxi là chất khí.
D. Oxi có 2 electron lớp ngoài cùng.
Câu 2: Số oxi hoá của lưu huỳnh trong các hợp chất: SO2, H2S, H2SO4, CuSO4 lần lượt là
A. 0, +4, +6, +6.
B. +4, -2, +6, +6.
C. 0, +4, +6, -6.
D . +4, +2, +6, +6.
Câu 3: Để phân biệt oxi và ozon có thể dùng chất nào sau đây?
A. Cu.
B. Hồ Hóah bột.
C. H2
D. Dung dịch KI và hồ Hóah bột.
Câu 4: Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. O3.
B. SO2.
C. H2SO4.
D. H2S.
Câu 5: Cho V lít SO2 (đktc) tác dụng hết với dung dịch Br2 dư. Thêm tiếp vào dung dịch sau phản ứng BaCl2 dư thu được 2,33 gam kết tủa. Thể tích V là
A. 0,11 lít.
B. 1,12 lít.
C. 0,224 lít.
D. 2,24 lít.
Câu 6: H2SO4 đặc, nguội có thể tác dụng được với tất cả chất trong dãy nào sau đây?
A. Mg, Zn.
B. Fe, Zn.
C. Al, Zn.
D. Fe, Al.
Câu 7: Hòa tan hoàn toàn 16 gam hỗn hợp Mg, Fe bằng dung dịch H2SO4 loãng vừa đủ. Sau phản ứng thấy khối lượng dung dịch tăng thêm 15,2 gam so với ban đầu. Khối lượng muối khan thu được sau khi cô cạn dung dịch là
A. 53,6 gam.
B. 54,4 gam.
C. 92 gam.
D. 92,8 gam.
Câu 8: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
A. Cu, Zn, Na.
B. K, Mg, Al, Fe, Zn.
C. Ag, Ba, Fe, Sn.
D. Au, Pt, Al.
Câu 9: Hấp thụ toàn bộ 4,48 lít SO2 (đktc) vào 300 ml dd NaOH 1M. Sản phẩm muối thu được là
A. Na2SO3.
B. Na2SO4, NaHSO4.
C. NaHSO3.
D. Na2SO3, NaHSO3.
Câu 10: Có các thí nghiệm sau:
(I) Nhúng thanh sắt vào dung dịch H2SO4 đặc, nguội.
(II) Sục khí H2S vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 loãng, nguội.
Số thí nghiệm xảy ra phản ứng hoá học là
A. 2.
B. 1
C. 3.
D. 4.
II. Tự luận (7 điểm)
Câu 1 ( 2 điểm): Axit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp. Hàng năm, các nước trên thế giới sản xuất ra khoảng 160 triệu tấn. Viết PTHH sản xuất H2SO4 từ FeS2 theo sơ đồ: FeS2 → SO2 → SO3 → oleum → H2SO4.
Câu 2 ( 2 điểm): Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt 3 lọ mất nhãn đựng các chất sau: H2SO4; HCl; Na2SO4.
Câu 3 ( 2 điểm): Hấp thụ hoàn toàn V lít SO2 (ở đktc) vào 2,2 lít nước vôi trong 0,1M thu được dung dịch X và 14,4 gam chất rắn Y. Xác định V. Giả sử SO2 tan trong nước không đáng kể.
Câu 4 ( 1 điểm): Hòa tan hết 8,775 gam hỗn hợp B gồm Mg và Al trong 75 gam dung dịch H2SO4 98% thu được dung dịch X và hỗn hợp khí Y gồm SO2 và H2S.Cho Y từ từ qua bình đựng KMnO4 dư thấy có 2,4 gam kết tủa xuất hiện, lọc bỏ kết tủa, cho phần dung dịch còn lại tác dụng với dung dịch BaCl2 dư thấy thu được 26,2125 gam kết tủa nữa. Tính C% của H2SO4 trong X và %Al trong hỗn hợp B.
2.2 Đáp án đề thi giữa kì 2 Hóa 10
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | B | D | B | C | A | B | B | D | C |
II. Tự luận (7 điểm)
Câu 1 ( 2 điểm):
FeS2 → SO2 → SO3 → oleum → H2SO4.
HS viết đúng mỗi PTHH 0,5 điểm. Thiếu cân bằng trừ ½ số điểm mỗi PT.
1/ 4FeS2 + 11O2 →(tº) 2SO2 + 8Fe2O3
2/ 2SO2 + O2 ⇔(xt, tº) 2SO3
3/ H2SO4 + nSO3 → H2SO4.nSO3
4/ H2SO4.nSO3 + nH2O → (n + 1) H2SO4.
Câu 2 ( 2 điểm):
Đánh số thứ tự từng lọ, trích mẫu thử (0,5 điểm)
Dùng dung dịch BaCl2 vào các mẫu thử nếu: xuất hiện kết tủa trắng là Na2SO4; H2SO4 (nhóm I). (0,5 điểm)
Còn lại không hiện tượng là HCl.
PTHH: (0,5 điểm)
BaCl2 + H2SO4 → BaSO4+ 2HCl
BaCl2 + Na2SO4 → BaSO4+ 2NaCl
Nhỏ dd Na2SO3 vào nhóm I nếu: có khí bay ra là H2SO4 còn lại không hiện tượng là Na2SO4 (0,5 điểm)
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Câu 3 ( 2 điểm):
Các phản ứng có thể xảy ra theo thứ tự: (0,5 điểm)
SO2 + Ca(OH)2 → CaSO3 + H2O (1)
SO2 + CaSO3 + H2O → Ca(HSO3)2 (2)
Số mol Y = số mol CaSO3 = 0,12 mol; số mol Ca(OH)2 = 0,22 mol
TH1: Chỉ xảy ra phản ứng 1 (0,5 điểm)
Theo pư 1: Số mol Ca(OH)2 pư = số mol Y = 0,12
→ số mol SO2 = 0,12 mol → V1 = 2,688 lít.
TH2: Xảy ra cả 2 phản ứng (0,5 điểm)
Tính toán được số mol SO2 = 0,32 mol → V2 = 7,168 lít.
Vậy có 2 nghiệm: V1 = 2,688 lít và V2 = 7,168 lít (0,5 điểm)
Câu 4 ( 1 điểm):
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2 MnSO4 + K2SO4 (0,25 điểm)
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2O
Tính được nS = 2,4/32 = 0,075 → nH2S = 0,075.
Áp dụng đl bảo toàn nguyên tố → nSO2 = nBaSO4 = 0,1125 mol
Quá trình khử: 2H2SO4 + 2e → SO2 + 2H2O + SO22- (0,25 điểm)
5H2SO4 + 8e → H2S + 4H2O + 4SO42-
Tính theo quá trình → nH2SO4 = 0,6 mol → nH2SO4 dư = 0,15 mol
Theo định luật bảo toàn khối lượng → mx = 74,025 gam (0,25 điểm)
→ C% axit = 19,86%
Gọi nMg = a (mol); nAl = b (mol) (0,25 điểm)
Áp dụng đl bảo toàn e → 2a + 3b = 0,825
Theo khối lượng → 24a + 27b = 8,775
Giải hệ → a =0,225; b = 0,125 → %mAl = 38,46%.
3. Đề thi giữa kì 2 Hóa 10 Cánh diều
3.1 Đề thi giữa kì 2 Hóa 10
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Phát biểu nào sau đây là sai?
A. Bán kính nguyên tử của clo lớn hơn bán kính nguyên tử của flo.
B. Độ âm điện của brom lớn hơn độ âm điện của iot.
C. Tính khử của ion Br– lớn hơn tính khử của ion Cl–.
D. Tính axit của HF mạnh hơn tính axit của HCl.
Câu 2: Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
A. Ag, CaCO3, CuO.
B. FeS, BaSO4, KOH.
C. AgNO3, (NH4)2CO3, Cu.
D. Mg(HCO3)2, AgNO3, CuO.
Câu 3: Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch NaCl có màng ngăn.
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Câu 4: Cho kim loại M tác dụng với Cl2 được muối X; cho kim loại M tác dụng với dung dịch HCl được muối Y. Nếu cho kim loại M tác dụng với dung dịch muối X ta cũng được muối Y. Kim loại M có thể là
A. Mg.
B. Zn.
C. Al.
D. Fe.
Câu 5: Khi cho dung dịch AgNO3 phản ứng với dung dịch nào sau đây sẽ cho kết tủa màu vàng đậm nhất?
A. Dung dịch HI.
B. Dung dịch HCl.
C. Dung dịch HBr.
D. Dung dịch HF.
Câu 6: Trong phản ứng: Cl2 + H2O ↔ HCl + HClO, clo đóng vai trò
A. không là chất oxi hóa, không là chất khử.
B. là chất oxi hóa.
C. là chất khử.
D. vừa là chất oxi hóa, vừa là chất khử.
Câu 7: Trong phòng thí nghiệm, dung dịch HF không được bảo quản trong bình làm bằng chất liệu nào?
A. Nhựa.
B. Gốm sứ.
C. Thủy Hóah.
D. Polime.
Câu 8: Cho 5,4 gam Al phản ứng hoàn toàn với dung dịch HCl loãng, dư thu được bao nhiêu lít khí H2 (đktc)?
A. 4,48 lít.
B. 2,24 lít.
C. 6,72 lít.
D. 7,84 lít.
Câu 9: Cho 0,1 mol KMnO4 tác dụng với dung dịch HCl dư, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít.
B. 5,6 lít.
C. 2,24 lít.
D. 0,112 lít.
Câu 10: Khi cho mẩu quỳ tím ẩm vào bình đựng khí Cl2, hiện tượng thu được là
A. quỳ tím chuyển sang màu đỏ.
B. quỳ tím không chuyển màu.
C. quỳ tím chuyển sang màu đỏ, sau đó mất màu.
D. quỳ tím chuyển sang màu xanh.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt các dd sau chứa trong các lọ riêng biệt mất nhãn: MgCl2, KBr, KCl.
Câu 2 ( 2 điểm): Cho m gam hỗn hợp G gồm: CaCO3 và Al vào một lượng vừa đủ V lít dung dịch HCl 2M. Sau phản ứng thu được dung dịch A và 8,96 lít khí B ở đktc. Cô cạn A thu được 37,8 gam muối khan.
1/ Xác định % khối lượng của các chất trong G.
2/ Tính CM của các chất trong A.
Câu 3 ( 2 điểm): Cho 5,965 gam hỗn hợp A gồm: NaX, NaY (X,Y là hai halogen liên tiếp, nguyên tử khối của X 3 dư. Kết thúc phản ứng thu được 1,435gam kết tủa. Xác định hai nguyên tố X, Y.
Câu 4 ( 1 điểm): Sục V lít Cl2 ở đktc vào 100ml dung dịch C gồm: NaF 1M; NaBr 3M và KI 2M thu được dung dịch D. Cô cạn D thu được 41,1 gam chất rắn khan E. Xác định V.
3.2 Đáp án đề kiểm tra giữa kì 2 Hóa học 10
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | D | D | B | D | A | D | C | C | B | C |
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
Đánh số thứ tự từng lọ, trích mẫu thử. (0,5 điểm)
Dùng dd NaOH nhận ra MgCl2 nhờ kết tủa trắng (0,5 điểm)
PTHH: MgCl2 + 2NaOH → Mg(OH)2 (↓) + 2NaCl.
Dùng dd AgNO3 nhận ra KCl (kết tủa trắng), KBr (kết tủa vàng nhạt). (0,5 điểm)
PTHH: (0,5 điểm)
AgNO3 + KCl → AgCl + KNO3
AgNO3 + KBr → AgBr + KNO3.
(viết đúng mỗi PTHH 0,25 điểm)
Câu 2 ( 2 điểm):
1. Gọi số mol CaCO3 = x; số mol Al = y; tính số mol khí = 0,4 mol. (0,25 điểm)
CaCO3 + 2HCl → CaCl2 + CO2 + H2O (0,5 điểm)
x → x (mol)
2Al + 6HCl → 2AlCl3 + 3H2
y → 1,5y (mol)
(mỗi PTHH đúng 0,25 điểm)
Lập hệ: (0,25 điểm)
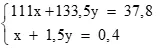
Giải hệ: x = 0,1; y = 0,2
Tính được %mCaCO3 = 64,935%; %mAl = 35,065%.
2. Tính số mol HCl pư = 0,8 mol và tính V = 0,4 lít. (0,25 điểm)
Tính số mol các chất tan trong A: CaCl2 0,1 mol và AlCl3 = 0,2 mol. (0,25 điểm)
Tính được: CMCaCl2 = 0,1:0,4 = 0,25M; CMAlCl3 = 0,2:0,4 = 0,5M. (0,25 điểm)
Câu 3 ( 2 điểm):
Trường hợp 1: X là Flo và Y là Clo. Ta có PTHH: (0,25 điểm)
Tính được số mol AgCl = 0,01 mol
NaCl + AgNO3 → AgCl + NaNO3 (0,5 điểm)
0,01 ← 0,01 (mol)
→ mNaCl = 0,01.58,5 = 0,585
Trường hợp 2: X khác F gọi X, Y là E (điều kiện: 35,5 E
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE (0,5 điểm)
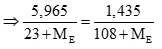
Giải PT → ME
Câu 4 ( 1 điểm):
Các pư có thể xảy ra theo thứ tự: (0,25 điểm)
Cl2 + 2KI → 2KCl + I2 (1)
0,1← 0,2 → 0,2 (mol)
Cl2 + 2NaBr → 2NaCl + Br2 (2)
0,3 → 0,3 (mol)
npư: x → 2x → 2x (mol)
Số mol các chất: NaF 0,1 mol; NaBr 0,3 mol; KI 0,2 mol
– Giả sử Cl2 phản ứng vừa đủ ở phản ứng 1. (0,25 điểm)
Theo pư 1: Chất rắn E gồm: NaF 0,1 mol; KCl 0,2 mol; NaBr 0,3 mol
m1 = 0,1.42 + 0,2.74,5 + 0,3.103 = 50 gam.
– Giả sử Cl2 phản ứng vừa đủ ở phản ứng 2. (0,25 điểm)
Theo phản ứng 1,2: Chất rắn E gồm: NaF 0,1 mol; KCl 0,2 mol; NaCl 0,3 mol
m2 = 0,1.42 + 0,2.74,5 + 0,3.58,5 = 36,65 gam.
Nhận xét: m2E 1 → Pư 2 mới xảy ra 1 phần
Gọi số mol Cl2 pư ở 2 là x mol: Theo pư 1,2: (0,25 điểm)
– E gồm: NaF 0,1 mol; KCl 0,2 mol; NaCl 2x mol; NaBr (0,3-2x) mol
Ptr: 0,1.42 + 0,2.74,5 + 2x.58,5 + (0,3-2x).103 = 41,1 x = 0,1
– Số mol Cl2 đã dùng = 0,1+x = 0,2 mol → V = 0,2.22,4 = 4,48 lít
……………
Tải file tài liệu để xem thêm đề thi giữa kì 2 Hóa học 10
