Download.vn Học tập Lớp 8
Bạn đang đọc: Chuyên đề nhận biết các chất hóa học lớp 8
Chuyên đề nhận biết các chất hóa học lớp 8 Bài tập nhận biết các chất trong môn Hóa học
Giới thiệu Tải về Bình luận
- 1
Mua tài khoản Download Pro để trải nghiệm website Download.vn KHÔNG quảng cáo & tải File cực nhanh chỉ từ 79.000đ. Tìm hiểu thêm Mua ngay
Chuyên đề nhận biết các chất hóa học lớp 8 là tài liệu vô cùng hữu ích mà Download.vn muốn giới thiệu đến quý thầy cô cùng các bạn học sinh lớp 8 cùng tham khảo.
Tài liệu bao gồm 14 trang tổng hợp toàn bộ lý thuyết và các dạng bài tập chương nhận biết các chất hóa học. Hi vọng với tài liệu này các bạn học sinh có thêm nhiều tài liệu tham khảo củng cố kiến thức để đạt được kết quả cao trong các bài kiểm tra, bài thi sắp tới. Nội dung chi tiết mời các bạn cùng theo dõi và tải tài liệu tại đây.
Chuyên đề nhận biết các chất hóa học lớp 8
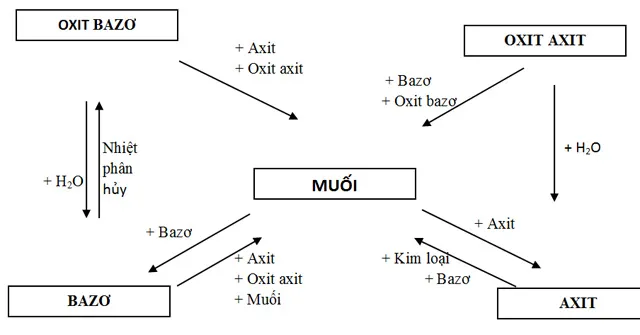
 Gia sư Thành Được www.daythem.edu.vn NhËn biÕt-T¸ch riªng – §iÒu chÕ chÊt A- NhËn biÕt c¸c chÊt:Cã nhiÒu ph-¬ng ph¸p nhËn biÕt: Ph-¬ng ph¸p vËt lÝ, sinh häc, ho¸ lÝ, ho¸ häc… Víich-¬ng tr×nh phæ th«ng, ®Ó nhËn biÕt c¸c chÊt (nguyªn tè, hîp chÊt, ion) chñ yÕu dïngph-¬ng ph¸p ho¸ häc.I-Nguyªn t¾c cña ph-¬ng ph¸p ho¸ häc:Dùa vµo c¸c ph¶n øng ®Æc tr-ng, nghÜa lµ nh÷ng ph¶n øng g©y ra c¸c hiÖn t-îng bªnngoµi mµ gi¸c quan chóng ta cã thÓ c¶m thô ®-îc.VÝ dô: B»ng m¾t, ta biÕt ®-îc c¸c ph¶n øng t¹o thµnh kÕt tña, tho¸t bät khÝ, hoµ tan,t¹o mµu, ®æi hoÆc mÊt mµu.B»ng mòi ta nhËn biÕt ®-îc c¸c ph¶n øng t¹o thµnh c¸c khÝ cã mïi ®Æc biÖt nh- NH3(mïi khai), H2S (mïi trøng thèi), SO2(mïi xèc), axit axetic (mïi giÊm), este (mïi th¬m)…§èi víi c¸c chÊt khÝ th× ph¶n øng ch¸y vµ ph¶n øng ng-ng tù h¬i n-íc còng lµ ph¶nøng ®Æc tr-ng.Chó ý: Kh«ng dïng c¸c ph¶n øng kh«ng ®Æc tr-ng ®Ó nhËn biÕt. VÝ dô dïng dungdÞch NaOH ®Ó nhËn biÕt dung dÞch HCl vµ ng-îc l¹i, v× mÆc dÇu ph¶n øng cã x¶y ranh-ng ta kh«ng quan s¸t ®-îc. II– C¸c kh¸i niÖm: +Thuèc thö chän ®Ó nhËn biÕt:C¸c ho¸ chÊt dïng ®Ó ph¶n øng víi chÊt ph©n tÝch®-îc gäi lµc¸c thuèc thö(kÓc¶ n-íc, qu× tÝm, phenoltalein). Trong c¸c bµi tËp vÒ nhËn biÕt cã thÓ chodïng thuèc thökh«ng h¹n chÕ, h¹n chÕhoÆckh«ng dïng thuèc thö(trong tr-êng hîp nµyb¶n th©nc¸c chÊt cÇn nhËn biÕt ®ãng vai trß lµ thuèc thö). + NhËn biÕtchÊt riªng rÏ(c¸c ho¸ chÊt cÇn nhËn biÕt chøa trong c¸c lä riªng biÖt) vµ nhËn biÕtchÊt trong hçn hîp(c¸c chÊt cÇn nhËn biÕt chøa trong cïng dung dÞch hoÆc cïng hçn hîp r¾n, bét). NhËn biÕt hçn hîp khã h¬n, v× ta nhËn biÕt mét chÊt nµo ®ã th× ph¶i xem c¸c chÊtkh¸c cã ph¶n øng t-¬ng tù kh«ng hoÆc g©y ra ph¶n øng kh¸c lµm c¶n trë ph¶n øng ®Æctr-ng cña chÊt cÇn nhËn biÕt.III– C¸c b-íc gi¶i: B-íc 1: Ph©n tÝch, nhËn xÐt. – X¸c ®Þnh lo¹i chÊt, lo¹i chøc cho tõng chÊt.
Gia sư Thành Được www.daythem.edu.vn NhËn biÕt-T¸ch riªng – §iÒu chÕ chÊt A- NhËn biÕt c¸c chÊt:Cã nhiÒu ph-¬ng ph¸p nhËn biÕt: Ph-¬ng ph¸p vËt lÝ, sinh häc, ho¸ lÝ, ho¸ häc… Víich-¬ng tr×nh phæ th«ng, ®Ó nhËn biÕt c¸c chÊt (nguyªn tè, hîp chÊt, ion) chñ yÕu dïngph-¬ng ph¸p ho¸ häc.I-Nguyªn t¾c cña ph-¬ng ph¸p ho¸ häc:Dùa vµo c¸c ph¶n øng ®Æc tr-ng, nghÜa lµ nh÷ng ph¶n øng g©y ra c¸c hiÖn t-îng bªnngoµi mµ gi¸c quan chóng ta cã thÓ c¶m thô ®-îc.VÝ dô: B»ng m¾t, ta biÕt ®-îc c¸c ph¶n øng t¹o thµnh kÕt tña, tho¸t bät khÝ, hoµ tan,t¹o mµu, ®æi hoÆc mÊt mµu.B»ng mòi ta nhËn biÕt ®-îc c¸c ph¶n øng t¹o thµnh c¸c khÝ cã mïi ®Æc biÖt nh- NH3(mïi khai), H2S (mïi trøng thèi), SO2(mïi xèc), axit axetic (mïi giÊm), este (mïi th¬m)…§èi víi c¸c chÊt khÝ th× ph¶n øng ch¸y vµ ph¶n øng ng-ng tù h¬i n-íc còng lµ ph¶nøng ®Æc tr-ng.Chó ý: Kh«ng dïng c¸c ph¶n øng kh«ng ®Æc tr-ng ®Ó nhËn biÕt. VÝ dô dïng dungdÞch NaOH ®Ó nhËn biÕt dung dÞch HCl vµ ng-îc l¹i, v× mÆc dÇu ph¶n øng cã x¶y ranh-ng ta kh«ng quan s¸t ®-îc. II– C¸c kh¸i niÖm: +Thuèc thö chän ®Ó nhËn biÕt:C¸c ho¸ chÊt dïng ®Ó ph¶n øng víi chÊt ph©n tÝch®-îc gäi lµc¸c thuèc thö(kÓc¶ n-íc, qu× tÝm, phenoltalein). Trong c¸c bµi tËp vÒ nhËn biÕt cã thÓ chodïng thuèc thökh«ng h¹n chÕ, h¹n chÕhoÆckh«ng dïng thuèc thö(trong tr-êng hîp nµyb¶n th©nc¸c chÊt cÇn nhËn biÕt ®ãng vai trß lµ thuèc thö). + NhËn biÕtchÊt riªng rÏ(c¸c ho¸ chÊt cÇn nhËn biÕt chøa trong c¸c lä riªng biÖt) vµ nhËn biÕtchÊt trong hçn hîp(c¸c chÊt cÇn nhËn biÕt chøa trong cïng dung dÞch hoÆc cïng hçn hîp r¾n, bét). NhËn biÕt hçn hîp khã h¬n, v× ta nhËn biÕt mét chÊt nµo ®ã th× ph¶i xem c¸c chÊtkh¸c cã ph¶n øng t-¬ng tù kh«ng hoÆc g©y ra ph¶n øng kh¸c lµm c¶n trë ph¶n øng ®Æctr-ng cña chÊt cÇn nhËn biÕt.III– C¸c b-íc gi¶i: B-íc 1: Ph©n tÝch, nhËn xÐt. – X¸c ®Þnh lo¹i chÊt, lo¹i chøc cho tõng chÊt. Gia sư Thành Được www.daythem.edu.vn – X¸c ®Þnh thuèc thö, ph¶n øng ®Æc tr-ng cho tõng lo¹i chÊt vµ tõng chÊt.– So s¸nh thÝ nghiÖm cÇn tiÕn hµnh víi thuèc thö, x¸c ®Þnh mét tr×nh tù tiÕn hµnh ®Ót×m c¸c chÊt theo mét tr×nh tù ®óng ®¾n, ng¾n gän, hîp lÝ.B-íc 2: Tr×nh bµy lêi gi¶i. CÇn nªu râ ®-îc c¸c ý sau:- C¸ch thøc tiÕn hµnh thÝ nghiÖm.- Chän thuèc thö.- HiÖn t-îng quan s¸t ®-îc.- KÕt luËn nhËn biÕt ®-îc chÊt nµo.-ViÕt ph-¬ng tr×nh ph¶n øng gi¶i thÝch.IV– Ph©n lo¹i c¸c bµi tËp nhËn biÕt Cã nhiÒu c¸ch ph©n lo¹i:- Theo thuèc thö ®em sö dông:Dïng thuèc thö kh«ng h¹n chÕ, h¹n chÕ hoÆckh«ng dïng thuèc thö.- NhËn biÕtchÊt riªng rÏvµ nhËn biÕtchÊt trong hçn hîp.1-NhËn biÕt thµnh phÇn cña mét chÊt hay mét chÊt cho biÕt.ViÖc kiÓm tra chÊt ®· ®-îc biÕt tr-íc thµnh phÇn cã thÓ ®-îc thùc hiÖn theo c¸c b-ícsau:- KiÓm tra tÝnh chÊt vËt lÝ: Mµu s¾c, tÝnh tan trong n-íc, mµu ngän löa…-KiÓm tra b»ng ph¶n øng ho¸ häc ®Æc tr-ng cho cation hoÆc anion cña chÊt b»ngthuèc thö thÝch hîp.VÝ dô 1: Lµm thÕ nµo ®Ó nhËn biÕt trong axit clohi®ric cã clo vµ hi®ro?Gi¶i: – LÊy mét Ýt dung dÞch axit clohi®ric cho t¸c dông víi dung dÞch AgNO3, xuÊthiÖn kÕt tña tr¾ng, ®Ó ngoµi ¸nh s¸ng ho¸ ®en. Chøng tá cã clo (Cl). Ag++ Cl= AgCl tr¾ng 2AgCl 2Ag + Cl2 (hoÆc cho t¸c dông víi MnO2, tocã khÝ tho¸t ra mµu vµnglôc, mïi h¾c- Cl2).-NhËn biÕt thuèc thö h¹n chÕ:Trong bµi tËp d¹ng nµy, h¹n chÕ vÒ sè l-îng thuèc thö, lo¹i thuèc thö hoÆc h¹n chÕc¶ sè l-îng vµ lo¹i thuèc thö; hoÆc cho sö dông mét chÊt nµo ®ã mµ th«i. Trong tr-ênghîp ®¬n gi¶n chØ dïng mét thuèc thö lµ cã thÓ ph©n biÖt ®-îc c¸c cation hoÆc c¸c anion.§iÒu nµy cã thÓ thùc hiÖn nÕu c¸c ph¶n øng kh«ng c¶n trë lÉn nhau.¸nh s¸ng
Gia sư Thành Được www.daythem.edu.vn – X¸c ®Þnh thuèc thö, ph¶n øng ®Æc tr-ng cho tõng lo¹i chÊt vµ tõng chÊt.– So s¸nh thÝ nghiÖm cÇn tiÕn hµnh víi thuèc thö, x¸c ®Þnh mét tr×nh tù tiÕn hµnh ®Ót×m c¸c chÊt theo mét tr×nh tù ®óng ®¾n, ng¾n gän, hîp lÝ.B-íc 2: Tr×nh bµy lêi gi¶i. CÇn nªu râ ®-îc c¸c ý sau:- C¸ch thøc tiÕn hµnh thÝ nghiÖm.- Chän thuèc thö.- HiÖn t-îng quan s¸t ®-îc.- KÕt luËn nhËn biÕt ®-îc chÊt nµo.-ViÕt ph-¬ng tr×nh ph¶n øng gi¶i thÝch.IV– Ph©n lo¹i c¸c bµi tËp nhËn biÕt Cã nhiÒu c¸ch ph©n lo¹i:- Theo thuèc thö ®em sö dông:Dïng thuèc thö kh«ng h¹n chÕ, h¹n chÕ hoÆckh«ng dïng thuèc thö.- NhËn biÕtchÊt riªng rÏvµ nhËn biÕtchÊt trong hçn hîp.1-NhËn biÕt thµnh phÇn cña mét chÊt hay mét chÊt cho biÕt.ViÖc kiÓm tra chÊt ®· ®-îc biÕt tr-íc thµnh phÇn cã thÓ ®-îc thùc hiÖn theo c¸c b-ícsau:- KiÓm tra tÝnh chÊt vËt lÝ: Mµu s¾c, tÝnh tan trong n-íc, mµu ngän löa…-KiÓm tra b»ng ph¶n øng ho¸ häc ®Æc tr-ng cho cation hoÆc anion cña chÊt b»ngthuèc thö thÝch hîp.VÝ dô 1: Lµm thÕ nµo ®Ó nhËn biÕt trong axit clohi®ric cã clo vµ hi®ro?Gi¶i: – LÊy mét Ýt dung dÞch axit clohi®ric cho t¸c dông víi dung dÞch AgNO3, xuÊthiÖn kÕt tña tr¾ng, ®Ó ngoµi ¸nh s¸ng ho¸ ®en. Chøng tá cã clo (Cl). Ag++ Cl= AgCl tr¾ng 2AgCl 2Ag + Cl2 (hoÆc cho t¸c dông víi MnO2, tocã khÝ tho¸t ra mµu vµnglôc, mïi h¾c- Cl2).-NhËn biÕt thuèc thö h¹n chÕ:Trong bµi tËp d¹ng nµy, h¹n chÕ vÒ sè l-îng thuèc thö, lo¹i thuèc thö hoÆc h¹n chÕc¶ sè l-îng vµ lo¹i thuèc thö; hoÆc cho sö dông mét chÊt nµo ®ã mµ th«i. Trong tr-ênghîp ®¬n gi¶n chØ dïng mét thuèc thö lµ cã thÓ ph©n biÖt ®-îc c¸c cation hoÆc c¸c anion.§iÒu nµy cã thÓ thùc hiÖn nÕu c¸c ph¶n øng kh«ng c¶n trë lÉn nhau.¸nh s¸ng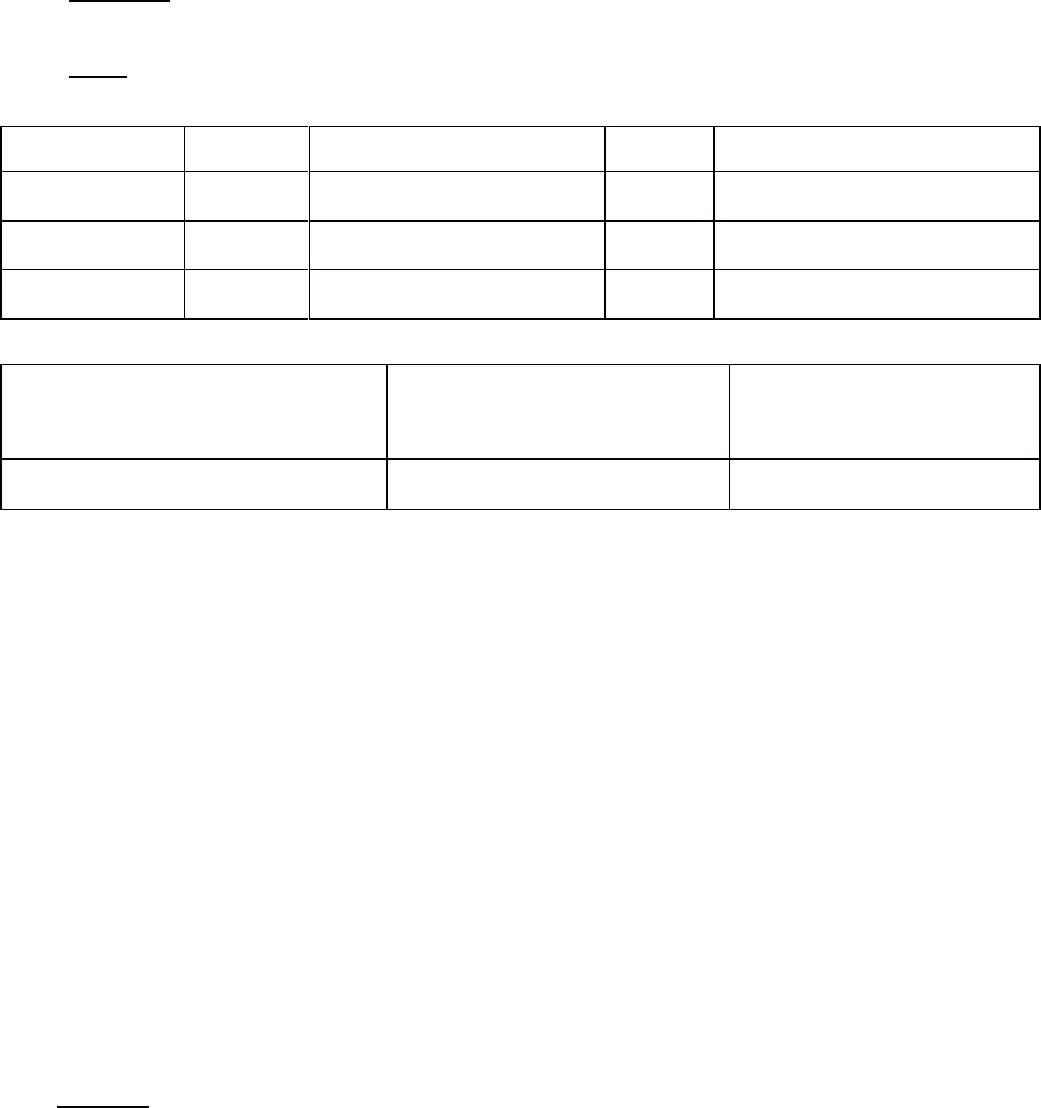 Gia sư Thành Được www.daythem.edu.vn VÝ dô 1: Cã ba dung dÞch (NH4)2SO4, NH4Cl, Na2SO4chøa trong c¸c lä mÊt nh·n.H·y dïng 1 ho¸ chÊt ®Ó ph©n biÖt c¸c dung dÞch trªn.Gi¶i: B-íc 1– Ph©n tÝch, nhËn xÐt (®-a ra ®Ó tham kh¶o, kh«ng cÇn ph¶i tr×nh bµy trong lêi gi¶i). ChÊtCationPh¶n øng ®Æc tr-ngAnionPh¶n øng ®Æc tr-ng(NH4)2SO4NH4+NH4++ OH= NH3 SO42SO42+ Ba2+= BaSO4 NH4Cl NH4+NH4++ OH= NH3 ClCl+ Ag+= AgClNa2SO4Na+Thö mµu ngän löaSO42SO42+ Ba2+= BaSO4 – Chän thuèc thö:+Ph©n biÖt cationNH4+vµ Na++Ph©n biÖt anionClvµ SO42ChÊt cÇn lÊyDïng anionOH.Dïng cationBa2+.Dung dÞch Ba(OH)2(Kh«ng dïng AgOH v× chÊt ®ã kh«ng bÒn, kh«ng tån t¹i). Chó ý: Ph©n biÖt 2 anion Clvµ SO42nªn chän ion Ba2+®Ó nhËn ra ion SO42tr-íc mµ kh«ng dïng ion Ag+®Ó ph©n biÖt ion Cl, v× Ag2SO4lµ chÊt Ýt tan, víi nång ®éion SO42®ñ lín còng cã thÓ cho kÕt tña! B-íc 2- Tr×nh bµy lêi gi¶i:-LÊy mçi dung dÞch mét Ýt, nhá vµo ®ã dung dÞch Ba(OH)2. -HiÖn t-îng: + Mét dung dÞch kh«ng cã kÕt tña, dung dÞch ®ã lµ NH4Cl. + Hai dung dÞch cã kÕt tña mµu tr¾ng. §un nãng, èng nµo cã khÝ tho¸tra mïi khai lµ dung dÞch (NH4)2SO4. èng cßn l¹i lµ dung dÞch Na2SO4. – Ph-¬ng tr×nh ph¶n øng: 2NH4Cl + Ba(OH)2= 2NH3 + BaCl2+ 2H2O(NH4)2SO4+ Ba(OH)2= 2NH3 + BaSO4 + 2H2O Na2SO4+ Ba(OH)2= 2NaOH + BaSO4 VÝ dô 2: Cã ba dung dÞch lo·ng lµ NaOH, H2SO4vµ HCl ®ùng trong ba b×nh kh«ngghi nh·n. ChØ dïng phÊn viÕt b¶ng (®¸ phÊn), lµm thÕ nµo ®Ó nhËn biÕt tõng chÊt ®ùngtrong mçi b×nh.
Gia sư Thành Được www.daythem.edu.vn VÝ dô 1: Cã ba dung dÞch (NH4)2SO4, NH4Cl, Na2SO4chøa trong c¸c lä mÊt nh·n.H·y dïng 1 ho¸ chÊt ®Ó ph©n biÖt c¸c dung dÞch trªn.Gi¶i: B-íc 1– Ph©n tÝch, nhËn xÐt (®-a ra ®Ó tham kh¶o, kh«ng cÇn ph¶i tr×nh bµy trong lêi gi¶i). ChÊtCationPh¶n øng ®Æc tr-ngAnionPh¶n øng ®Æc tr-ng(NH4)2SO4NH4+NH4++ OH= NH3 SO42SO42+ Ba2+= BaSO4 NH4Cl NH4+NH4++ OH= NH3 ClCl+ Ag+= AgClNa2SO4Na+Thö mµu ngän löaSO42SO42+ Ba2+= BaSO4 – Chän thuèc thö:+Ph©n biÖt cationNH4+vµ Na++Ph©n biÖt anionClvµ SO42ChÊt cÇn lÊyDïng anionOH.Dïng cationBa2+.Dung dÞch Ba(OH)2(Kh«ng dïng AgOH v× chÊt ®ã kh«ng bÒn, kh«ng tån t¹i). Chó ý: Ph©n biÖt 2 anion Clvµ SO42nªn chän ion Ba2+®Ó nhËn ra ion SO42tr-íc mµ kh«ng dïng ion Ag+®Ó ph©n biÖt ion Cl, v× Ag2SO4lµ chÊt Ýt tan, víi nång ®éion SO42®ñ lín còng cã thÓ cho kÕt tña! B-íc 2- Tr×nh bµy lêi gi¶i:-LÊy mçi dung dÞch mét Ýt, nhá vµo ®ã dung dÞch Ba(OH)2. -HiÖn t-îng: + Mét dung dÞch kh«ng cã kÕt tña, dung dÞch ®ã lµ NH4Cl. + Hai dung dÞch cã kÕt tña mµu tr¾ng. §un nãng, èng nµo cã khÝ tho¸tra mïi khai lµ dung dÞch (NH4)2SO4. èng cßn l¹i lµ dung dÞch Na2SO4. – Ph-¬ng tr×nh ph¶n øng: 2NH4Cl + Ba(OH)2= 2NH3 + BaCl2+ 2H2O(NH4)2SO4+ Ba(OH)2= 2NH3 + BaSO4 + 2H2O Na2SO4+ Ba(OH)2= 2NaOH + BaSO4 VÝ dô 2: Cã ba dung dÞch lo·ng lµ NaOH, H2SO4vµ HCl ®ùng trong ba b×nh kh«ngghi nh·n. ChØ dïng phÊn viÕt b¶ng (®¸ phÊn), lµm thÕ nµo ®Ó nhËn biÕt tõng chÊt ®ùngtrong mçi b×nh.