Giải Hoá 11 Bài 1: Mở đầu về cân bằng hóa học là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 11 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Cánh diều trang 6, 7, 8, 9, 10, 11, 12, 13, 14.
Bạn đang đọc: Hoá 11 Bài 1: Mở đầu về cân bằng hóa học
Soạn Hóa 11 Cánh diều Bài 1 được trình bày khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án cho riêng mình. Vậy sau đây là giải Hóa 11 Mở đầu về cân bằng hóa học Cánh diều, mời các bạn cùng theo dõi tại đây.
Hoá 11 Bài 1: Mở đầu về cân bằng hóa học
Trả lời câu hỏi vận dụng Hóa 11 Bài 1
Vận dụng 1 trang 10
Hãy cho biết trong công nghiệp, để thu được nhiều NH3 hơn thì cần tăng hay giảm nồng độ N2 và H2.
Gợi ý đáp án
Biểu thức hằng số cân bằng của phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g) là:
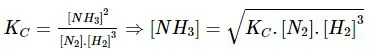
Vận dụng 2 trang 13
Quá trình tổng hợp NH3 trong công nghiệp từ N2 và H2 nên thực hiện ở áp suất cao hay áp suất thấp? Giải thích. Tìm hiểu thông tin, cho biết phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất nào.
Gợi ý đáp án
Phản ứng tổng hợp NH3 từ N2 và H2:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Dự đoán: Phản ứng nên thực hiện ở áp suất cao, do ở áp suất cao, cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều giảm áp suất (hay chính là chiều giảm số mol khí), tức chiều thuận (tăng hiệu suất tổng hợp NH3).
Thực tế, phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất 200 – 300 atm.
Vận dụng 3 trang 13
Thành phần chính của tinh dầu chuối là ester CH3COOCH2CH2CH(CH3)2. Để thu được hỗn hợp chất chứa nhiều ester này thì cần thay đổi nồng độ các chất như thế nào trong cân bằng:
CH3COOH(aq) + ROH(aq) ⇌ CH3CHOOR(aq) + H2O(l)
Với R – là (CH3)2CHCH2CH2 –.
Gợi ý đáp án
Để nâng cao hiệu suất của phản ứng (tức thu được hỗn hợp chất chứa nhiều ester này) có thể lấy dư một trong hai chất đầu (tăng nồng độ một trong hai chất đầu) hoặc làm giảm nồng độ các sản phẩm.
Giải bài tập Hóa 11 trang 14
Bài 1 trang 14
Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là không đúng?
A. Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
D. Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Gợi ý đáp án
Đáp án đúng là: C
Khi phản ứng thuận nghịch ở trạng thái cân bằng thì:
+ Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
+ Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
+ Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Bài 2 trang 14
Cho 0,4 mol SO2 và 0,6 mol O2 vào một bình dung tích 1 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,3 mol. Tính hằng số cân bằng KC của phản ứng tổng hợp SO3 ở nhiệt độ trên.
Gợi ý đáp án
Do dung tích bình là 1 lít nên giá trị nồng độ bằng giá trị của số mol.
Ta có: 2SO2(g) + O2(g) ⇌ 2SO3(g)
Ban đầu: 0,4 0,6 0 M
Phản ứng: 0,3 0,15 0,3 M
Cân bằng: 0,1 0,45 0,3 M
Hằng số cân bằng KC của phản ứng tổng hợp SO3 là:
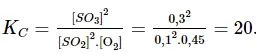
Bài 3 trang 14
Nhũ đá được hình thành trong các hang động liên quan đến cân bằng sau đây:
Ca(HCO3)2 (aq) ⇌ CaCO3(s) + CO2(aq) + H2O(l)
Nếu nồng độ CO2 hoà tan trong nước tăng lên thì có thuận lợi cho sự hình thành nhũ đá hay không? Giải thích.
Gợi ý đáp án
Nếu nồng độ CO2 hoà tan trong nước tăng lên thì không thuận lợi cho sự hình thành nhũ đá. Do nồng độ CO2 tăng, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ CO2, tức chiều nghịch.