Giải Hoá 11 Bài 2: Cân bằng trong dung dịch nước là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 11 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Kết nối tri thức với cuộc sống trang 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26.
Bạn đang đọc: Hóa 11 Bài 2: Cân bằng trong dung dịch nước
Soạn Hóa 11 Kết nối tri thức Bài 2 được trình bày khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án cho riêng mình. Vậy sau đây là giải Hóa 11 Cân bằng trong dung dịch nước Kết nối tri thức, mời các bạn cùng theo dõi tại đây.
Soạn Hóa 11 Bài 2: Cân bằng trong dung dịch nước
Giải Hóa 11 Bài 2 trang 16, 17, 18, 19, 20, 21, 22, 23, 24, 25
Câu hỏi 1 trang 18
Viết phương trình điện li của các chất sau: HF, HI, Ba(OH)2, KNO3, Na2SO4.
Gợi ý đáp án
Phương trình điện li:
HF ⇌ H+ + F–
HI → H+ + I–
Ba(OH)2 → Ba2+ + 2OH–
KNO3 → K+ + NO3–
Na2SO4 → 2Na+ + SO42-
Câu hỏi 2 trang 20
Dựa vào thuyết acid – base của Br∅nsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau:
a) CH3COOH + H2O ⇌ CH3COO– + H3O+
b) S2- + H2O ⇌ HS– + OH–
Gợi ý đáp án
Thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
a) CH3COOH + H2O ⇌ CH3COO– + H3O+
Trong phản ứng trên: CH3COOH cho H+, CH3COOH là acid; H2O nhận H+, H2O là base.
b) S2- + H2O ⇌ HS– + OH–
Trong phản ứng trên: H2O cho H+, H2O là acid; S2- nhận H+, S2- là base.
Câu hỏi 3 trang 21
Một loại dầu gội đầu có nồng độ ion OH- là 10-5,17 mol/ L.
a) Tính nồng độ ion H+, pH của loại dầu gội nói trên.
b) Môi trường của loại dầu gội trên là acid, base hay trung tính?
Gợi ý đáp án
a)Ta có: [H+].[OH]– = 10-14
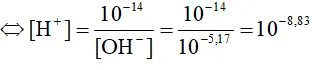
Ta có: pH = -log[H+] = 8,83.
b) pH > 7 nên môi trường của loại dầu gội trên là base.
Câu hỏi 4 trang 21
Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo pH đo được giá trị pH là 4,52.
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp để giảm độ chua, tăng độ pH của đất.
Gợi ý đáp án
a) Giá trị pH là 4,52
b) Biện pháp để giảm độ chua, tăng độ pH của đất:
+ Xây dựng hệ thống tưới, tiêu nước để rửa chua cho đất.
+ Sử dụng vôi bột, tro bếp … bón cho đất.
+ Bón phân hữu cơ, phân chuồng ủ hoai mục … cho đất (cách này giúp giảm pH của đất một cách từ từ, nếu muốn giảm pH của đất một cách nhanh chóng thì cách này không phù hợp).
Câu hỏi 5 trang 21
pH của dung dịch nào sau đây có giá trị nhỏ nhất?
A. Dung dịch HCl 0,1 M.
B. Dung dịch CH3COOH 0,1 M.
C. Dung dịch NaCl 0,1 M.
D. Dung dịch NaOH 0,01 M.
Gợi ý đáp án
Đáp án đúng là: A
|
Dung dịch |
HCl 0,1 M |
CH3COOH 0,1 M |
NaCl 0,1 M |
NaOH 0,01 M |
|
pH |
1 |
> 1 |
7 |
12 |
Câu hỏi 6 trang 22
Đo PH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ của ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Gợi ý đáp án
Đáp án đúng là: C
Câu hỏi 7 trang 22
Nước Javel (chứa NaClO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ClO- nhận proton của nước để tạo thành HClO.
a) Viết phương trình hoá học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên.
b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
Gợi ý đáp án
a) Phương trình hoá học của phản ứng xảy ra:
ClO– + H2O ⇌ HClO + OH–
Trong phản ứng trên ClO– nhận H+ từ nước nên là base; H2O là acid.
b) Dựa vào phản ứng ta thấy môi trường của nước Javel là môi trường base.
Câu hỏi 8 trang 26
Nêu một số điểm cần chú ý trong quá trình chuẩn độ.
Gợi ý đáp án
Một số điểm cần lưu ý trong quá trình chuẩn độ:
– Tránh để các hoá chất như dung dịch HCl, dung dịch NaOH bắn vào tay, mắt.
– Các dụng cụ thuỷ tinh (bình tam giác, burette, pipette …) dễ vỡ, cần cẩn thận.
Câu hỏi 9 trang 26
Nêu một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ.
Gợi ý đáp án
Một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ:
+ Sai số do phương pháp hay quy trình chuẩn độ: phản ứng hoá học không hoàn toàn, chỉ thị đổi màu khi chưa đến điểm tương đương …
+ Sai số do dụng cụ như: dụng cụ chưa được rửa sạch, dụng cụ chưa được chuẩn hoá…
+ Sai số do người làm thí nghiệm: mắt nhìn không chính xác, cẩu thả trong thực nghiệm …
+ Sai số do hoá chất không tinh khiết.