Giải Hoá 11 Bài 7: Sulfuric acid và muối sulfate là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 11 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Cánh diều trang 44, 45, 46, 47, 48, 49, 50.
Bạn đang đọc: Hóa 11 Bài 7: Sulfuric acid và muối sulfate
Soạn Hóa 11 Cánh diều Bài 7 được trình bày khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án cho riêng mình. Vậy sau đây là giải Hóa 11 Sulfuric acid và muối sulfate Cánh diều, mời các bạn cùng theo dõi tại đây.
Giải Hóa 11 Bài 7: Sulfuric acid và muối sulfate
Trả lời câu hỏi Vận dụng Hóa 11 trang 48
Quá trình sản xuất sulfuric acid có thể ảnh hưởng đến môi trường và người tham gia sản xuất. Hãy tìm hiểu nguyên nhân và đề xuất một số biện pháp hạn chế những tác hại đó.
Gợi ý đáp án
– Một số nguyên nhân dẫn đến rủi ro, sự cố:
+ Nổ bình chứa, ống dẫn khí SO2, SO3.
+ Vỡ, thủng các bồn chứa acid.
+ Rò rỉ hệ thống đường ống dẫn hơi, các van, mối nối trên hệ thống đường ống.
+ Cháy nổ do chập điện…
– Một số biện pháp đề xuất để hạn chế tác hại:
+ Thực hiện nghiêm túc nội quy an toàn lao động; trang bị đầy đủ các phương tiện bảo vệ cá nhân (quần áo bảo hộ lao động, kính mắt, gang tay, ủng …) khi làm việc.
+ Thường xuyên kiểm tra máy móc, thiết bị vận hành…
+ Sử dụng các thiết bị tách mù tiên tiến, có hiệu xuất xử lí cao, ví dụ như thiết bị tách mù acid bằng lọc bụi tĩnh điện ướt (ở nhà máy Super phosphate Lâm Thao) …
Giải bài tập Hóa 11 Cánh diều trang 50
Bài 1 trang 50
a) Tính thể tích dung dịch H2SO4 98% (D = 1,84 g mL-1) cần dùng để pha chế thành 500 mL dung dịch H2SO4 0,05 M.
b) Tính thể tích dung dịch H2SO4 0,05 M cần dùng để trung hoà 10 mL dung dịch NaOH có pH = 13.
Gợi ý đáp án
a) Số mol H2SO4 có trong dung dịch cần pha chế là:
n = 0,5.0,05 = 0,025 mol;
Khối lượng dung dịch H2SO4 98% cần dùng để pha chế là:
Thể tích dung dịch H2SO4 98% cần dùng để pha chế là:
b) Dung dịch NaOH có pH = 13 ⇒
⇒ nNaOH = 0,1.0,01 = 0,001 (mol)
Phản ứng trung hoà:
H+ + OH− → H2O
⇒ nH+ = nOH− ⇔ 2.VH2SO4.0,05 = 0,001 ⇒ VH2SO4 = 0,01 (L) = 10(mL).
Bài 2 trang 50
Các ao, hồ, suối, sông quanh miệng núi lửa thường có môi trường acid. Điển hình là hồ Kawah Ijen, miền Đông đảo Java, Indonesia. Hồ nằm cao hơn mặt nước biển 2 300 m, được cho là “hồ acid” lớn nhất thế giới. Giá trị pH của nước trong hồ dao động từ 0,13 đến 0,50 chủ yếu do sulfuric acid gây nên.
Hãy giải thích nguyên nhân có mặt của sulfuric acid trong hồ.
Gợi ý đáp án
Khi núi lửa hoạt động, các hợp chất chứa sulfur sẽ bị oxi hoá tạo ra khí SO2. Sau đó SO2 tiếp tục bị oxi hoá tạo ra SO3.
SO3 sinh ra tan vào nước hồ, đó chính là nguyên nhân sự có mặt của sulfuric acid trong hồ.
Bài 3 trang 50
Dựa vào tính chất nào để phân biệt nhanh muối magnesium sulfate và muối barium sulfate?
Gợi ý đáp án
Ở 20 oC, độ tan của muối magnesium sulfate là 35,1 gam/ 100 gam nước; còn độ tan của muối barium sulfate là 0,245 miligam/ 100 gam nước.
Do đó, có thể dựa vào tính chất vật lí (khả năng tan trong nước) để phân biệt nhanh muối magnesium sulfate và muối barium sulfate.
Bài 4 trang 50
Viết phương trình hoá học của các phản ứng theo dãy chuyển hoá dưới đây.
FeS2 → SO2 → SO3 → H2SO4 → (NH4)2SO4.
Gợi ý đáp án
(1) 4FeS2 + 11O2 2Fe2O3 + 8SO2;
(2) 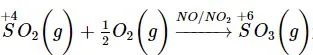 ;
;
(3) SO3 + H2O → H2SO4;
(4) H2SO4 + 2NH3 → (NH4)2SO4