Giải Hóa 10 Bài 11: Liên kết ion là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Kết nối tri thức với cuộc sống trang 51→54 thuộc Chương 3 Hóa 10.
Bạn đang đọc: Hóa học 10 Bài 11: Liên kết ion
Hóa 10 Bài 11 trang 51→54 sách Kết nối tri thức được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án. Vậy sau đây là giải Hóa 10 trang 51→54 sách Kết nối tri thức, mời các bạn cùng theo dõi tại đây.
Hóa học 10 Bài 11: Liên kết ion
Giải Hóa 10 Bài 11 Liên kết ion trang 51→54
I. Sự tạo thành ion
Câu 1
Hoàn thành các sơ đồ tạo thành ion sau:
a) Li → Li+ + ?
b) Be → ? + 2e
c) Br + ? → Br–
d) O + 2e → ?
Gợi ý đáp án
a) Li → Li+ + 1e
b) Be → Be2+ + 2e
c) Br + 1e → Br–
d) O + 2e → O2-
Câu 2
Viết cấu hình electron của các ion K+, Mg2+, F-, S2. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
Gợi ý đáp án
Cấu hình electron của K (Z = 19): 1s22s22p63s23p64s1.
K → K+ + 1e
⇒ Cấu hình electron của K+ là 1s22s22p63s23p6
Cấu hình electron của K+ giống với khí hiếm Ar.
Cấu hình electron của Mg (Z =12): 1s22s22p63s2.
⇒ Cấu hình electron của Mg2+ là 1s22s22p6.
Mg → Mg2+ + 2e
Cấu hình electron của Mg2+ giống với khí hiếm Ar.
Cấu hình electron của F (Z =9) là 1s22s22p5.
F + 1e → F-
⇒ Cấu hình electron của F– là 1s22s22p6.
Cấu hình electron của F– giống với khí hiếm Ne.
Cấu hình electron của S là 1s22s22p63s23p4.
S + 2e → S2–
⇒ Cấu hình electron của S2– là 1s22s22p63s23p6.
Cấu hình electron của S2– giống với khí hiếm Ar.
Câu 3
Vì sao một ion O2- kết hợp được với hai ion Li+?
Gợi ý đáp án
O + 2e → O2–
Li → Li+ + e
O có xu hướng nhận thêm 2 electron, còn Li có xu hướng nhường 1 electron để đạt tới cấu hình bền vững.
II. Sự tạo thành liên kết ion
Câu 4
Cho các ion Na+, Mg2+, O2-, Cl–. Những ion nào có thể kết hợp với nhau tạo thành liên kết ion?
Gợi ý đáp án
Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
⇒ Các cặp ion có thể kết hợp với nhau để tạo liên kết ion là: Na+ và O2–, Mg2+ và O2–, Na+ và Cl–, Mg2+ và Cl–.
Câu 5
Mô tả sự tạo thành liên kết ion trong:
a) Calcium oxide.
b) Magnesium chloride.
Gợi ý đáp án
a) Khi kim loại calcium kết hợp với phi kim oxygen, tạo thành các ion Ca2+ và O2–, các ion này có điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Biểu diễn sự hình thành liên kết ion trong phân tử CaO như sau:
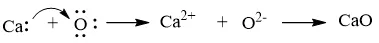
b) Khi kim loại magnesium kết hợp với phi kim chlorine, tạo thành các ion Mg2+ và Cl–, các ion này có điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Biểu diễn sự hình thành liên kết ion trong phân tử MgCl2 như sau:
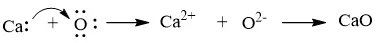
III. Tinh thể ion
Câu 6
a) Vì sao muối ăn có nhiệt độ nóng chảy cao (801oC)?
b) Hợp chất ion dẫn điện trong trường hợp nào? Vì sao?
Gợi ý đáp án
a) Muối ăn (NaCl) là tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên khó nóng chảy.
b)
Hợp chất tĩnh điện khi các hợp chất tan trong nước hoặc ở trạng thái nóng chảy.
Vì khi tan trong nước, các ion bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do.
Khi ở trạng thái nóng chảy, các ion có thể chuyển động khá tự do.

