Giải Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học Chân trời sáng tạo là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách giáo khoa trang 88→ 93 thuộc chương 5: Năng lượng hóa học.
Bạn đang đọc: Hóa học 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Soạn Hóa 10 Bài 14 được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án.
Giải Hóa 10: Tính biến thiên enthalpy của phản ứng hóa học
Giải Hóa học 10 Bài 14 trang 92, 93
Bài 1
Tính của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g)→ 2Cl2(g) + 2H2O(g)
Lời giải chi tiết:
a) N2H4(g) → N2(g) + 2H2(g)
Công thức cấu tạo của N2H4: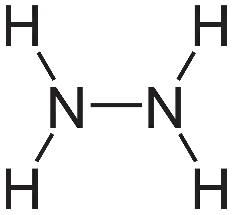
 Delta_r H_{298}^o=mathrm{E}_{mathrm{b}}left(mathrm{N}_2 mathrm{H}_4right)-mathrm{E}_{mathrm{b}}left(mathrm{N}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2right)” width=”353″ height=”21″ data-type=”0″ data-latex=”=>Delta_r H_{298}^o=mathrm{E}_{mathrm{b}}left(mathrm{N}_2 mathrm{H}_4right)-mathrm{E}_{mathrm{b}}left(mathrm{N}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2right)” data-src=”https://tex.vdoc.vn?tex=%3D%3E%5CDelta_r%20H_%7B298%7D%5Eo%3D%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BN%7D_2%20%5Cmathrm%7BH%7D_4%5Cright)-%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BN%7D_2%5Cright)-2%20%5Ccdot%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BH%7D_2%5Cright)”>
Delta_r H_{298}^o=mathrm{E}_{mathrm{b}}left(mathrm{N}_2 mathrm{H}_4right)-mathrm{E}_{mathrm{b}}left(mathrm{N}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2right)” width=”353″ height=”21″ data-type=”0″ data-latex=”=>Delta_r H_{298}^o=mathrm{E}_{mathrm{b}}left(mathrm{N}_2 mathrm{H}_4right)-mathrm{E}_{mathrm{b}}left(mathrm{N}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2right)” data-src=”https://tex.vdoc.vn?tex=%3D%3E%5CDelta_r%20H_%7B298%7D%5Eo%3D%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BN%7D_2%20%5Cmathrm%7BH%7D_4%5Cright)-%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BN%7D_2%5Cright)-2%20%5Ccdot%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BH%7D_2%5Cright)”>
b.
 Delta_r H_{298}^o=4 . mathrm{E}_{mathrm{b}}(mathrm{HCl})+mathrm{E}_{mathrm{b}}left(mathrm{O}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{Cl}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2 mathrm{O}right) ” width=”580″ height=”35″ data-type=”0″ data-latex=”=>Delta_r H_{298}^o=4 . mathrm{E}_{mathrm{b}}(mathrm{HCl})+mathrm{E}_{mathrm{b}}left(mathrm{O}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{Cl}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2 mathrm{O}right) ” data-src=”https://tex.vdoc.vn?tex=%3D%3E%5CDelta_r%20H_%7B298%7D%5Eo%3D4%20.%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D(%5Cmathrm%7BHCl%7D)%2B%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BO%7D_2%5Cright)-2%20%5Ccdot%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BCl%7D_2%5Cright)-2%20%5Ccdot%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BH%7D_2%20%5Cmathrm%7BO%7D%5Cright)%20%5C%5C”>
Delta_r H_{298}^o=4 . mathrm{E}_{mathrm{b}}(mathrm{HCl})+mathrm{E}_{mathrm{b}}left(mathrm{O}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{Cl}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2 mathrm{O}right) ” width=”580″ height=”35″ data-type=”0″ data-latex=”=>Delta_r H_{298}^o=4 . mathrm{E}_{mathrm{b}}(mathrm{HCl})+mathrm{E}_{mathrm{b}}left(mathrm{O}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{Cl}_2right)-2 cdot mathrm{E}_{mathrm{b}}left(mathrm{H}_2 mathrm{O}right) ” data-src=”https://tex.vdoc.vn?tex=%3D%3E%5CDelta_r%20H_%7B298%7D%5Eo%3D4%20.%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D(%5Cmathrm%7BHCl%7D)%2B%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BO%7D_2%5Cright)-2%20%5Ccdot%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BCl%7D_2%5Cright)-2%20%5Ccdot%20%5Cmathrm%7BE%7D_%7B%5Cmathrm%7Bb%7D%7D%5Cleft(%5Cmathrm%7BH%7D_2%20%5Cmathrm%7BO%7D%5Cright)%20%5C%5C”>
Bài 2
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6 (l) trong khí oxygen, tạo thành CO 2 (g) và H 2 O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H 8 (g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H 6 (l).
Gợi ý đáp án
– Xét phản ứng: C6H6(l) + 15/2 O2(g) → 6CO2(g) + 3H2O(l)
|
Chất |
C6H6(l) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
+49,00 |
0 |
-393,50 |
-285,84 |
Khi đốt cháy 1 mol C6H6 (l)
= 6.(-393,50) + 3.(-285,84) – (+49,00) – 15/2.0
= -3267,52 kJ
Ta có: 1,0 g benzene = 1/78 (mol)
=> Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzene = -3267,52 . 1/78 = -41,89 kJ
– Xét phản ứng:
|
Chất |
C3H8(g) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
-105,00 |
0 |
-393,50 |
-285,84 |
Khi đốt cháy 1 mol C3H8(g)
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
Ta có: 1,0 g C3H8 = 1/44 (mol)
=> Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g C3H8 = -2218,86 . 1/44 = -50,43 kJ
=> Lượng nhiệt sinh ra khi đốt cháy 1,0 g propane nhiều hơn khi đốt cháy 1,0 g benzene
Bài 3
Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm:
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị đối với phản ứng
Lời giải chi tiết:
– Xét phản ứng:
|
Chất |
Fe(s) |
Al2O3(s) |
Al(s) |
Fe2O3(s) |
|
|
0 |
-1676,00 |
0 |
-825,50 |
= 2.0 + 1.(-1676,00) – 2.0 – 1.(-825,50)
= -850,50 kJ
Phản ứng nhiệt nhôm diễn ra sẽ sinh ra lượng nhiệt lớn là 850,50 kJ
Bài 4
Cho phương trình nhiệt hóa học sau:
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3
b) Giá trị của phản ứng: SO3(g) → SO2(g) + ½ O2(g) là bao nhiêu?
Gợi ý đáp án
a)
– Mol của 74,6 g SO2 = 74,6 : 64 = 373/320 (mol)
Chuyển 1 mol SO2 thành SO3 sinh ra lượng nhiệt là 98,5 kJ
Chuyển 373/320 mol SO2 thành SO3 sinh ra lượng nhiệt là y kJ
=> y = 98,5 x 373/320 = 114,81 kJ
=> Lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3 là 114,81 kJ
b)
– Xét phản ứng:
– Xét phương trình:
Bài 5
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hóa học sau:
2H2(g) + O2(g) → 2H2O(g)
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen
Lời giải chi tiết:
a) Xét phản ứng: 2H2(g) + O2(g) → 2H2O(g)
=> Hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn
Bài 6
Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) xrightarrow{{{t^o}}} 3CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận
Gợi ý đáp án
– Dựa vào nhiệt tạo thành:
|
Chất |
C3H8(g) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
-105,00 |
0 |
-393,50 |
-285,84 |
 {Delta _r}H_{298}^o = 3.{Delta _f}H_{298}^o(CO2) + 4.{Delta _f}H_{298}^o(H2O) – {Delta _f}H_{298}^o(C3H8) – 5.{Delta _f}H_{298}^o(O2)” width=”604″ height=”21″ data-type=”0″ data-latex=”=> {Delta _r}H_{298}^o = 3.{Delta _f}H_{298}^o(CO2) + 4.{Delta _f}H_{298}^o(H2O) – {Delta _f}H_{298}^o(C3H8) – 5.{Delta _f}H_{298}^o(O2)” data-src=”https://tex.vdoc.vn?tex=%3D%3E%20%7B%5CDelta%20_r%7DH_%7B298%7D%5Eo%20%3D%203.%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(CO2)%20%2B%204.%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(H2O)%20-%20%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(C3H8)%20%E2%80%93%205.%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(O2)”>
{Delta _r}H_{298}^o = 3.{Delta _f}H_{298}^o(CO2) + 4.{Delta _f}H_{298}^o(H2O) – {Delta _f}H_{298}^o(C3H8) – 5.{Delta _f}H_{298}^o(O2)” width=”604″ height=”21″ data-type=”0″ data-latex=”=> {Delta _r}H_{298}^o = 3.{Delta _f}H_{298}^o(CO2) + 4.{Delta _f}H_{298}^o(H2O) – {Delta _f}H_{298}^o(C3H8) – 5.{Delta _f}H_{298}^o(O2)” data-src=”https://tex.vdoc.vn?tex=%3D%3E%20%7B%5CDelta%20_r%7DH_%7B298%7D%5Eo%20%3D%203.%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(CO2)%20%2B%204.%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(H2O)%20-%20%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(C3H8)%20%E2%80%93%205.%7B%5CDelta%20_f%7DH_%7B298%7D%5Eo(O2)”>
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
– Dựa vào năng lượng liên kết:
 {Delta _r}H_{298}^o = Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)” width=”454″ height=”21″ data-type=”0″ data-latex=”=> {Delta _r}H_{298}^o = Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)” data-src=”https://tex.vdoc.vn?tex=%3D%3E%20%7B%5CDelta%20_r%7DH_%7B298%7D%5Eo%20%3D%20Eb(C3H8)%20%2B%205.Eb(O2)%20%E2%80%93%203.Eb(CO2)%20%E2%80%93%204.Eb(H2O)”>
{Delta _r}H_{298}^o = Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)” width=”454″ height=”21″ data-type=”0″ data-latex=”=> {Delta _r}H_{298}^o = Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)” data-src=”https://tex.vdoc.vn?tex=%3D%3E%20%7B%5CDelta%20_r%7DH_%7B298%7D%5Eo%20%3D%20Eb(C3H8)%20%2B%205.Eb(O2)%20%E2%80%93%203.Eb(CO2)%20%E2%80%93%204.Eb(H2O)”>
= 2.347 + 8.413 + 5.498 – 6.745 – 8.467 = -1718 kJ