Giải Hóa học 9 Bài 16 giúp các bạn học sinh có thêm nhiều gợi ý tham khảo để trả lời các câu hỏi phần nội dung bài học và câu hỏi cuối bài Tính chất hóa học của kim loại thuộc chương 2 Kim loại kèm theo 10 câu hỏi trắc nghiệm khách quan.
Bạn đang đọc: Hoá học 9 Bài 16: Tính chất hóa học của kim loại
Soạn Hóa 9 bài 16 Tính chất hóa học của kim loại được biên soạn với các lời giải chi tiết, đầy đủ và chính xác bám sát chương trình sách giáo khoa. Hi vọng đây sẽ là tài liệu cực kì hữu ích hỗ trợ các em học sinh lớp 9 trong quá trình giải bài tập. Ngoài ra các bạn xem thêm nhiều tài liệu khác tại chuyên mục Hóa học 9.
Hoá học 9 Bài 16: Tính chất hóa học của kim loại
Lý thuyết Tính chất hóa học của kim loại
I. Tác dụng với phi kim
1. Với oxi
Nhiều kim loại phản ứng được với oxi tạo thành oxit.
3Fe + 2O2 Fe3O4
Trừ Ag, Au, Pt không phản ứng được với oxi
2. Với lưu huỳnh
– Nhiều kim loại phản ứng được với lưu huỳnh tạo thành muối sunfua (=S)
2Al + 2S Al2S3
3. Phản ứng với clo
Nhiều kim loại phản ứng được với clo tạo thành muối clorua (-Cl)
2Fe + 3Cl2 2FeCl3
II. Tác dụng với axit
Dung dịch axit HCl, H2SO4 loãng (chỉ có kim loại đứng trước H mới phản ứng)
2Al + 6HCl → 2AlCl3 + 3H2
III. Tác dụng với dung dịch muối
Trừ K, Na, Ca, Ba không đẩy được kim loại vì tác dụng ngay với nước
Kim loại đứng trước đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng.
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
Giải bài tập Hóa 9 Bài 16 trang 51
Câu 1
Kim loại có những tính chất hóa học nào? Lấy ví dụ và viết các phuwong trình hóa học minh họa với kim loại magie.
Gợi ý đáp án
Kim loại có những tính chất hóa học chung:
1. Phản ứng của kim loại với phi kim:
2Mg + O2 → 2MgO
Mg + Cl2 → MgCl2
2. Phản ứng của kim loại với dung dịch axit:
Mg + 2HCl → MgCl2 + H2 ↑
Mg + H2SO4loãng → MgSO4 + H2 ↑
3. Phản ứng của kim loại với dung dịch muối:
Mg + CuSO4 → MgSO4 + Cu.
Câu 2
Hãy hoàn thành các phương trình hóa học sau đây:
a) … + HCl -⇒ MgCl2 + H2
b) … + AgNO3 ⇒ Cu(NO3)2 + Ag
c) … + … ⇒ ZnO
d) … + Cl2 ⇒ HgCl2
e) … + S ⇒ K2S.
Gợi ý đáp án
Phương trình hóa học:
a) Mg + 2HCl → MgCl2 + H2 ↑
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
c) 2Zn + O2 → 2ZnO
d) Hg + Cl2 → HgCl2
e) 2K + S → K2S.
Câu 3
Viết các phương trình hóa học xảy ra giữa các cặp chất sau đây:
a) Kẽm + axit sunfuric loãng.
b) Kẽm + dung dịch bạc nitrat.
c) Natri + lưu huỳnh.
d) Canxi + clo.
Gợi ý đáp án
Các phương trình phản ứng hóa học:
a) Zn + H2SO4loãng → ZnSO4 + H2 ↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
c) 2Na + S → Na2S
d) Ca + Cl2 → CaCl2.
Câu 4
Dựa vào tính chất hóa học của kim loại, hãy viết các phương trình hóa học biểu diễn các chuyển hóa sau đây:
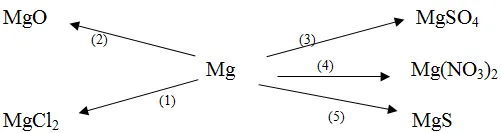
Gợi ý đáp án
(1) Mg + Cl2 → MgCl2
(2) 2Mg + O2 → 2MgO
(3) Mg + H2SO4loãng → MgSO4 + H2 ↑
(4) Mg + 2AgNO3 → Mg(NO3)2 + 2Ag ↓
(5) Mg + S → MgS
Câu 5
Dự đoán hiện tượng và viết phương trình hóa học xảy ra, khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào trong ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Gợi ý đáp án
a) Khối màu nâu tạo thành:
2Fe + 3Cl2 → 2FeCl3
b) Dung dịch CuCl2 nhạt màu xanh, kim loại màu đỏ bám vào đinh sắt.
Fe + CuCl2 → FeCl2 + Cu ↓
c) Zn tan dần, dung dịch CuSO4 nhạt màu xanh, kim loại màu đỏ bám vào viên kẽm.
Zn + CuSO4 → ZnSO4 + Cu ↓
Câu 6
Ngâm một lá kẽm trong 20 g dung dịch muối đồng sunfat 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Gợi ý đáp án
1 mol 1 mol 1 mol 1 mol
? 0,0125 mol ?
Theo phương trình:
Theo phương trình:
Ta có: mdd sau pứ =
Câu 7
Ngâm một lá đồng trong 20 ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52 g. Hãy xác định nồng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Gợi ý đáp án
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Gọi x là số mol Cu phản ứng
Theo phương trình ta có: nAg sinh ra = 2nCu pư = 2x mol
Khối lượng lá đồng tăng thêm 1,52g ⇒ mAg sinh ra – mCu pư = 1,52
⇒ 108. 2x – 64x = 1,52 ⇒ x = 0,01 (mol)
Theo pt nAgNO3 = 2.nCu = 2. 0,01 = 0,02 mol
Nồng độ dung dịch AgNO3: M
Trắc nghiệm Hóa 9 Bài 16
Câu 1. Dãy nào dưới đây gồm các dung dịch muối tác dụng được với kim loại Mg?
A. ZnCl2, Fe(NO3)2 và CuSO4
B. CaCl2, NaCl và Cu(NO3)2
C. CaCl2, NaNO3 và FeCl3
D. Ca(NO3)2, FeCl2 và CuSO4
Câu 2. Để làm sạch dung dịch muối Cu(NO3)2 có lẫn muối AgNO3, có thể dùng kim loại nào sau đây?
A. Mg
B. Ag
C. Cu
D. Fe
Câu 3. Dãy gồm các kim loại phản ứng được với H2SO4 loãng
A. Al, Fe và Cu
B. Al, Zn và Fe
C. Zn, Cu và Ag
D. Zn, Al và Cu
Câu 4. Dãy kim loại phản ứng được với nước ở nhiệt độ thường
A. Na, Fe, K
B. Na, K, Li
C. Na, Li, Mg
D. Na, li, Fe
Câu 5. Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch NaOH
B. H2O và dung dịch HCl
C. Dung dịch NaOH và H2O
D. Dung dịch CuCl2 và H2O
Câu 6. Khi cho kim loại Mg (dư) vào dung dịch gồm 2 muối Cu(NO3)2 và AgNO3, sản phẩm thu được gồm
A. Hai kim loại và một muối
B. Hai kim loại và hai muối
C. Ba kim loại và một muối
D. Ba kim loại và hai muối
Câu 7. Kim loại có hóa trị II. Cho 8,4 gam kim loại này tác dụng hết với dung dịch HCl sinh ra 7,84 lít khí hidro (đktc). Kim loại M là:
A. Cu
B. Zn
C. Mg
D. Fe
Câu 8. Cho 4,6 gam Na tác dụng hoàn toàn với 35,6 gam nước. Nồng độ % của dung dịch tạo thành là:
A. 10%
B. 15%
C. 20%
D. 25%
Câu 9. Ngâm một đinh sắt trong 10 ml dung dịch CuSO4 1M. Khối lượng Cu thu được sau phản ứng là:
A. 0,64 gam
B. 0,32 gam
C. 1,28 gam
D. 0,48 gam
Câu 10. Để phân biệt được các dung dịch HCl, H2SO4 và Ba(OH)2 chỉ cần dùng kim loại nào sau đây?
A. K
B. Na
C. Ba
D. Cu
Phần đáp án câu hỏi trắc nghiệm
| 1A | 2C | 3B | 4B | 5A |
| 6C | 7C | 8C | 9A | 10C |