Giải Hóa học 9 Bài 32 giúp các bạn học sinh có thêm nhiều gợi ý tham khảo để trả lời 6 câu hỏi trong SGK Hóa 9 trang 103 và trong SBT được nhanh chóng thuận tiện hơn.
Bạn đang đọc: Hóa học 9 Bài 32: Luyện tập chương 3 Phi kim – Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Soạn Hóa 9 bài 32 Luyện tập chương 3 Phi kim – Sơ lược về bảng tuần hoàn các nguyên tố hóa học được biên soạn với các lời giải chi tiết, đầy đủ và chính xác bám sát chương trình sách giáo khoa. Hi vọng đây sẽ là tài liệu cực kì hữu ích hỗ trợ các em học sinh lớp 9 trong quá trình giải bài tập. Ngoài ra các bạn xem thêm nhiều tài liệu khác tại chuyên mục Hóa học 9.
Hóa học 9 Bài 32: Luyện tập chương 3
Tóm tắt lý thuyết Luyện tập chương 3
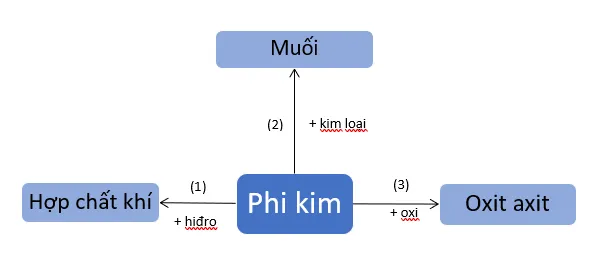
1. Tính chất hóa học của phi kim
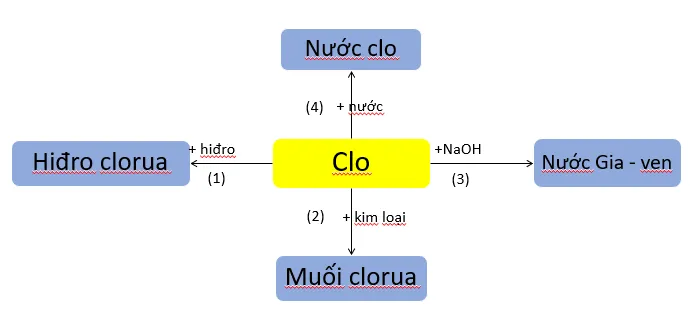
2. Tính chất hóa học của clo
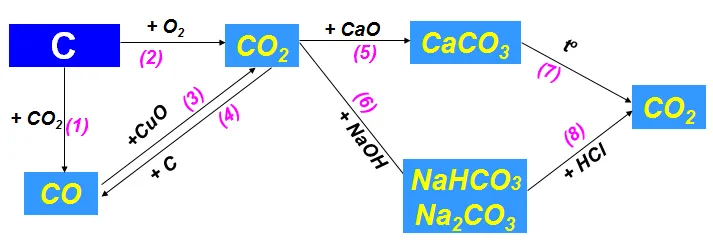
3. Tính chất hóa học các hợp chất của cacbon
4. Bảng tuần hoàn các nguyên tố hóa học
a) Cấu tạo của bảng tuần hoàn
- Ô nguyên tố
- Chu kỳ
- Nhóm
b) Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân:
Số lớp electron của nguyên tử tăng dần.
Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
Giải bài tập Hóa 9 Bài 32 trang 103
Câu 1
Căn cứ vào sơ đồ 1, hãy viết các phương trình hoá học với phi kim cụ thể là lưu huỳnh.
Gợi ý đáp án
S + H2 H2S
S + 2Na Na2S
S + O2 SO2
Câu 2
Hãy viết các phương trình hoá học biểu diễn tính chất hoá học của clo theo sơ đồ 2.
Gợi ý đáp án
(1) H2 + Cl2 2HCl
(2) 2Fe + 3Cl2 → 2FeCl3
(3) Cl2 + 2NaOH → NaCl + NaClO + H2O
(4) Cl2 (k) + H2O (l) → HCl (dd) + HClO (dd)
Câu 3
Hãy viết các phương trình hoá học biểu diễn tính chất hoá học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong các phản ứng đó.
Gợi ý đáp án
(1) C + O2 CO↑
(2) C + O2 CO2↑
(3) 2CO + O2 2CO2↑
(4) CO2 + C 2CO2↑
(5) CO2 + CaO → CaCO3
(6) CO2 + 2NaOH → Na2CO3 + H2O
(7) CaCO3 CaO + CO2↑
(8) Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Câu 4
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng tuần hoàn các nguyên tố hoá học. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hoá học đặc trưng của A.
- So sánh tính chất hoá học của A với các nguyên tố lân cận.
Gợi ý đáp án
- Số hiệu là 11
- Cấu tạo nguyên tử: Na
- Tính chất hóa học đặc trưng là kim loại hoạt động mạnh
- Tính chất hóa học của A mạnh hơn Mg, Al
Câu 5
a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
Gợi ý đáp án
a) Gọi CTHH của oxit sắt là: FexOy
Phương trình hóa học
FexOy + yCO → xFe + yCO2
Số mol Fe là
nFe = 22,4/56 = 0,4mol
Theo PTHH ta có:
Số mol FexOy là 0,4/x
Suy ra: (56x + 16y).(0,4/x) = 32
=> x : y = 2 : 3
Từ khối lượng mol là 160 ta suy ra công thức phân tử của oxit sắt Fe2O3
b. Phương trình hóa học
CO2 + Ca(OH)2 → CaCO3 + H2O
Số mol CO2 = (0,4 x 3)/2 = 0,6mol
Suy ra số mol CaCO3 là: 0,6mol
Khối lượng của CaCO3 là: mCaCO3 = 0,6 x 100 = 60gam
Câu 6
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dần khí X vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Gợi ý đáp án
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
nMnO2 = nCl2 = 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
nNaOH pư = 0,5.2 = 1,6 mol
nNaOH bđ = 0,5.4 = 2 mol
nNaOH dư = 2 – 1,6 = 0,4 mol
CMNaCl = 0,8/0,5 = 1,6M
CMNaClO = 0,8/0,5 = 1,6M
CMNaOH = 0,4/0,5 = 0,8 M
Giải SBT Hóa học 9 Bài 32
Bài 32.1
Ngâm hỗn hợp các kim loại Al, Cu, Fe trong mỗi dung dịch sau:
a) Dung dịch CuSO4 (dư).
b) Dung dịch AgNO3 (dư).
c) Dung dịch FeSO4 (dư).
Viết các phương trình hoá học. Kim loại nào thu được trong mỗi trường hợp?
Lời giải:
– Kim loại Cu thu được sau khi ngâm hỗn hợp các kim loại Al, Cu, Fe vào dung dịch CuSO4 dư
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu ↓
Fe + CuSO4 → FeSO4 + Cu ↓
– Kim loại Ag thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch AgNO3 dư:
Al + 3AgNO3 → Al(NO3)3 + 3Ag ↓
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag ↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
– Kim loại Fe và Cu thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch FeSO4dư:
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe ↓
Bài 32.3
Có bốn mẫu khí A, B, C, D đựng riêng biệt trong các bình thủy tinh. Mỗi khí có một số tính chất trong các tính chất sau:
A. Cháy trong không khí tạo ra chất lỏng không màu (ở nhiệt độ thường), chất lỏng này làm cho đồng(II) sunfat khan màu trắng chuyển thành màu xanh.
B. Độc, cháy với ngọn lửa màu xanh, sinh ra chất khí làm đục nước vôi trong.
C. Không cháy nhưng làm cho ngọn lửa cháy sáng chói hơn.
D. Không cháy mà còn làm tắt ngọn lửa và làm quỳ tím ẩm hoá đỏ.
Khí nào nói trên là: hiđro; oxi; cacbon đioxit; cacbon oxit?
Lời giải:
A: Khí H2; C: Khí O2;
B: Khí CO; D: Khí CO2.
Bài 32.4
Cặp nguyên tố nào sau đây dễ kết hợp với nhau để tạo thành một hợp chất ổn định?
a) Zn, Ne; b) H, S; c) Br, Be; d) O, Na; e) K, Kr.
Lời giải:
Những cặp nguyên tố dễ kết hợp với nhau để tạo thành hợp chất ổn định:
b) H, S cho hợp chất H2S; c) Br, Be cho hợp chất BeBr2;
d) O, Na cho hợp chất Na2O
Bài 32.5
Có 4 lá kim loại: sắt, đồng, nhôm, bạc. Làm thế nào để có thể nhận biết được mỗi kim loại bằng phương pháp hoá học. Viết các phương trình hoá học.
Lời giải:
– Kim loại nào tan trong dung dịch NaOH đặc tạo bọt khí bay ra là Al.
– Ba kim loại còn lại, kim loại nào tan trong dung dịch HCl và tạo bọt khí bay lên là Fe.
– Hai kim loại còn lại, kim loại nào đẩy được bạc ra khỏi dung dịch AgNO3 là Cu.
– Kim loại còn lại là Ag (không phản ứng với dung dịch AgNO3.
Bài 32.6
Trong phòng thí nghiệm có 3 lọ mất nhãn đựng ba chất bột trắng là: BaCO3, NaCl, Na2CO3. Làm thế nào để nhận ra hoá chất trong mỗi lọ với điều kiện chỉ dùng thêm dung dịch HCl loãng?
Lời giải:
– Lần lượt cho 3 chất vào 3 ống nghiệm đựng dung dịch HCl, nếu chất nào tan và có khí bay ra là Na2CO3, BaCO3 và chất nào tan mà không có khí bay ra là NaCl.
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
– Sau đó hoà tan một ít Na2CO3 và BaCO3 vào nước. Chất nào tan trong nước là Na2CO3
Chất không tan trong nước là BaCO3.
Bài 32.7
Hình vẽ 3.5 là thiết bị điều chế khí clo trong phòng thí nghiệm.
a) X và Y là những chất nào trong số các chất sau?
X: H2O, dd HCl, dd H2SO4, dd NaOH, dd NaCl.
Y: NaCl, CaCO3, MnO2, CuCl2, Na2SO4, KMnO4.
Viết phương trình hoá học điều chế khí clo từ những chất đã chọn ở trên.
Lời giải:
a) X là: dd HCl
Y là: MnO2, KMnO4
b) Phương trình hoá học của phản ứng điều chế clo.
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
