Giải Khoa học tự nhiên 8 Bài 11: Muối giúp các em học sinh lớp 8 tham khảo, nhanh chóng trả lời các câu hỏi phần thảo luận, luyện tập trang 48, 49, 50, 51, 52 sách Kết nối tri thức với cuộc sống.
Bạn đang đọc: KHTN 8 Bài 11: Muối
Qua đó, cũng giúp thầy cô tham khảo để soạn giáo án Bài 11 Chương II: Một số hợp chất thông dụng trong sách giáo khoa Khoa học tự nhiên 8 Kết nối tri thức với cuộc sống cho học sinh của mình. Mời thầy cô và các em cùng theo dõi nội dung chi tiết trong bài viết dưới đây của Download.vn:
Giải KHTN Lớp 8 Bài 11: Muối
Khái niệm
Câu 1: Viết công thức của các muối sau: potassium sulfate, sodium hydrogensulfate, sodium hydrogencarbonate, sodium chloride, sodium nitrate, calcium hydrogenphosphate, magnesium sulfate, copper(II) sulfate.
Trả lời:
- Potassium sulfate: K2SO4;
- Sodium hydrogensulfate: NaHSO4;
- Sodium hydrogencarbonate: NaHCO3;
- Sodium chloride: NaCl;
- Sodium nitrate: NaNO3;
- Calcium hydrogenphosphate: CaHPO4;
- Magnesium sulfate: MgSO4;
- Copper(II) sulfate: CuSO4
Câu 2: Gọi tên các muối sau: AlCl3; KCl; Al2(SO4)3; MgSO4; NH4NO3; NaHCO3.
Trả lời:
- AlCl3: aluminium chloride;
- KCl: potassium chloride;
- Al2(SO4)3: aluminium sulfate;
- MgSO4: magnesium sulfate;
- NH4NO3: ammonium nitrate;
- NaHCO3: sodium hydrogencarbonate.
Câu 3: Viết phương trình hóa học của phản ứng tạo thành muối KCl và MgSO4.
Trả lời:
– Một số phương trình hoá học của phản ứng tạo thành muối KCl:
2K + 2HCl → 2KCl + H2
KOH + HCl → KCl + H2O
K2O + 2HCl → 2KCl + H2O
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
– Một số phương trình hóa học của phản ứng tạo thành muối MgSO4:
Mg + H2SO4 → MgSO4 + H2
Mg(OH)2+ H2SO4 → MgSO4 + H2O
MgO + H2SO4→ MgSO4 + H2O
MgCO3 + H2SO4 → MgSO4 + CO2 + H2O.
Tính chất hóa học
Trong dung dịch, giữa các cặp chất nào sau đây có xảy ra phản ứng? Viết phương trình hoá học của các phản ứng đó.
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Ca(NO3)2 | ? | ? | ? | ? |
| BaCl2 | ? | ? | ? | ? |
| HNO3 | ? | ? | ? | ? |
Trả lời:
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Ca(NO3)2 | × | – | × | – |
| BaCl2 | × | – | × | – |
| HNO3 | × | – | – | – |
(“×”: xảy ra phản ứng; “-”: không xảy ra phản ứng)
Phương trình hóa học:
Ca(NO3)2 + Na2CO3→ CaCO3 + 2NaNO3
Ca(NO3)2 + Na2SO4 → CaSO4 + 2NaNO3
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
2HNO3 + Na2CO3 → 2NaNO3 + CO2+ H2O.
Mối quan hệ giữa các hợp chất vô cơ
Tính chất hoá học của các hợp chất vô cơ được tóm tắt bằng sơ đồ dưới đây:
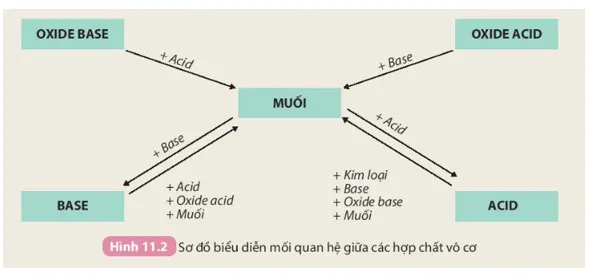
Dựa vào sơ đồ Hình 11.2 và cho biết tính chất của oxide, acid, base. Viết phương trình hoá học minh hoạ.
Trả lời:
– Tính chất của oxide:
+ Oxide base tác dụng với acid tạo thành muối và nước. Ví dụ:
CaO + 2HCl → CaCl2 + H2O.
+ Oxide acid tác dụng với dung dịch base tạo thành muối và nước. Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O.
– Tính chất của acid:
+ Tác dụng với kim loại tạo thành muối và khí. Ví dụ:
Fe + 2HCl → FeCl2 + H2.
+ Tác dụng với base tạo thành muối và nước. Ví dụ:
HCl + NaOH → NaCl + H2O.
+ Tác dụng với oxide base tạo thành muối và nước. Ví dụ:
H2SO4 + Na2O → Na2SO4 + H2O.
+ Tác dụng với muối tạo thành muối mới và acid mới. Ví dụ:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
– Tính chất của base:
+ Tác dụng với acid tạo thành muối và nước. Ví dụ:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
+ Tác dụng với oxide acid tạo thành muối và nước. Ví dụ:
Ca(OH)2 + CO2 → CaCO3 + H2O.
+ Tác dụng với dung dịch muối tạo thành muối mới và base mới. Ví dụ:
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.

