Giải Khoa học tự nhiên 8 Bài 12: Oxide giúp các em học sinh lớp 8 trả lời các câu hỏi phần thảo luận, luyện tập trang 56, 57, 58, 59, 60 sách Chân trời sáng tạo.
Bạn đang đọc: KHTN 8 Bài 12: Oxide
Giải KHTN 8 Bài 12 Chân trời sáng tạo giúp các em học sinh hiểu được kiến thức về khái niệm, tính chất hóa học và ứng dụng của Oxide. Đồng thời là tư liệu hữu ích giúp thầy cô soạn giáo án cho riêng mình. Vậy sau đây là nội dung chi tiết bài giải KHTN 8 Bài 12 Oxide mời các bạn cùng theo dõi và tải tại đây.
Giải Khoa học tự nhiên 8 Bài 12: Oxide
Câu hỏi thảo luận KHTN 8 Bài 12 Chân trời sáng tạo
Câu 1
Thành phần của các chất ở Hình 12.1 có đặc điểm gì giống nhau?

Trả lời:
Điểm giống nhau: Các hợp chất này đều gồm 2 nguyên tố, trong đó có 1 nguyên tố là oxygen.
Câu 2
Viết phương trình hóa học của phản ứng ở Ví dụ 2.
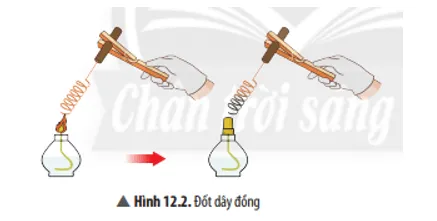
Trả lời:
Phương trình hoá học: 2Cu + O2 2CuO.
Câu 3
Viết phương trình hoá học của phản ứng xảy ra ở Ví dụ 4.

Trả lời:
Phương trình hoá học: C + O2 CO2.
Câu 4
Thành phần của gỉ sét có chứa Fe2O3. Từ Ví dụ 5, hãy cho biết vì sao giấm ăn có thể làm sạch được gỉ sét trên bề mặt dụng cụ làm bằng sắt – thép.
Trả lời:
Giấm ăn có tính acid nên có thể phản ứng với gỉ sét tạo thành muối tan dễ rửa trôi.
6CH3COOH + Fe2O3 → 2(CH3COO)3Fe + 3H2O.
Câu 5
Khi tiến hành các thí nghiệm với oxide của các kim loại beryllium, lead (chì), chromium (hóa trị III), ta thấy chúng đều vừa tan được trong dung dịch HCl, vừa tan được trong dung dịch NaOH. Theo em các oxide này được gọi là oxide gì.
Trả lời:
Các oxide này là oxide lưỡng tính do vừa tan được trong dung dịch HCl (acid), vừa tan được trong dung dịch NaOH (kiềm).
Câu 6
Hãy nêu hiện tượng và viết phương trình hoá học của phản ứng xảy ra ở Thí nghiệm 1. Nếu thay dung dịch HCl bằng dung dịch H2SO4 thì có phản ứng hoá học xảy ra không? Giải thích.
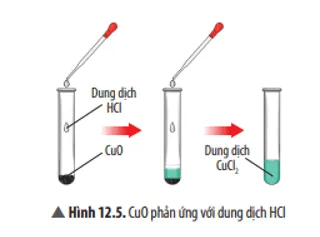
Trả lời:
Hiện tượng: CuO tan dần, sau phản ứng thu được dung dịch có màu xanh.
Phương trình hoá học: CuO + 2HCl → CuCl2 + H2O.
Nếu thay HCl bằng H2SO4 thì phản ứng vẫn diễn ra, do CuO là oxide base nên tác dụng được với H2SO4 là acid.
Câu 7
Quan sát Thí nghiệm 2 (Hình 12.6), hãy nêu hiện tượng và phản ứng hóa học của phản ứng xảy ra trong cốc thuỷ tinh.
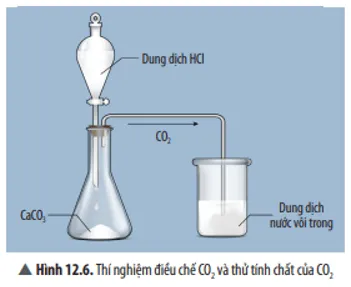
Trả lời:
Hiện tượng: Có kết tủa trắng xuất hiện.
Phương trình hoá học: CO2 + Ca(OH)2 → CaCO3 + H2O.
Luyện tập Khoa học tự nhiên 8 Bài 12 CTST
Luyện tập trang 56
Chất nào là oxide trong các chất sau: ZnO; SiO2; KNO3; Fe2O3; Cl2O7; K2CO3?
Trả lời:
Chất là oxide: ZnO; SiO2; Fe2O3; Cl2O7.
Luyện tập trang 57
Hãy viết các phương trình hoá học giữa khí oxygen và đơn chất tương ứng để tạo ra các oxide sau: Na2O, SO2, ZnO.
Trả lời:
4Na + O2 → 2Na2O
S + O2 SO2
2Zn + O2 2ZnO.
Luyện tập trang 58
Cho các oxide sau: Fe2O3; SiO2; K2O; SO2; NO2; BaO; CO2; CuO; CaO. Oxide nào trong các oxide trên là oxide base, oxide acid?
Trả lời:
Oxide base: Fe2O3; K2O; BaO; CuO; CaO.
Oxide acid: SiO2; SO2; NO2; CO2.
Luyện tập trang 60
Hãy chọn oxide và acid tương ứng, viết phương trình hoá học tạo ra các muối sau:
a) CaCl2. b) MgSO4.
c) FeCl2. d) Fe2(SO4)3.
Trả lời:
a) CaO + 2HCl → CaCl2 + H2O
b) MgO + H2SO4 → MgSO4 + H2O
c) FeO + 2HCl → FeCl2 + H2O
d) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
Luyện tập trang 61
Có các oxide sau: SO3, P2O5, CO, MgO. Oxide nào phản ứng được với dung dịch KOH? Oxide nào phản ứng được với dung dịch HCl? Viết phương trình hoá học của phản ứng.