Giải Khoa học tự nhiên 8 Bài 6: Tính theo phương trình hoá học giúp các em học sinh lớp 8 trả lời các câu hỏi phần thảo luận, luyện tập trang 32, 33, 34 sách Chân trời sáng tạo.
Bạn đang đọc: KHTN 8 Bài 6: Tính theo phương trình hoá học
Giải KHTN 8 Bài 6 Chân trời sáng tạo giúp các em học sinh hiểu được kiến thức biết cách làm bài tập tính theo phương trình hóa học. Đồng thời là tư liệu hữu ích giúp thầy cô soạn giáo án cho riêng mình. Vậy sau đây là nội dung chi tiết bài giải KHTN 8 Bài 6 Tính theo phương trình hoá học mời các bạn cùng theo dõi và tải tại đây.
KHTN 8 Bài 6: Tính theo phương trình hoá học
Câu hỏi thảo luận KHTN 8 Chân trời sáng tạo Bài 6
Câu 1
Các chất sau phản ứng trong các thí nghiệm (1), (2) và (3) gồm những chất nào?
Trả lời:
Chất sau phản ứng trong thí nghiệm (1) là: HCl;
Chất sau phản ứng trong thí nghiệm (2) là: HCl; H2.
Chất sau phản ứng trong thí nghiệm (3) là: HCl; Cl2.
Câu 2
Trong Thí nghiệm (2) và (3), chất nào là chất thiếu và chất nào là chất dư?
Trả lời:
Trong thí nghiệm (2): Cl2 thiếu, H2 dư;
Trong thí nghiệm (3): H2 thiếu; Cl2 dư.
Câu 3
Phản ứng nào xảy ra vừa đủ trong các thí nghiệm (1), (2) và (3)?
Trả lời:
Phản ứng trong thí nghiệm (1) xảy ra vừa đủ.
Câu 4
Sản phẩm tạo thành trong 3 thí nghiệm (Bảng 6.1) là chất nào? Để xác định lượng sản phẩm tạo thành cần dựa vào lượng chất thiếu hay chất dư?
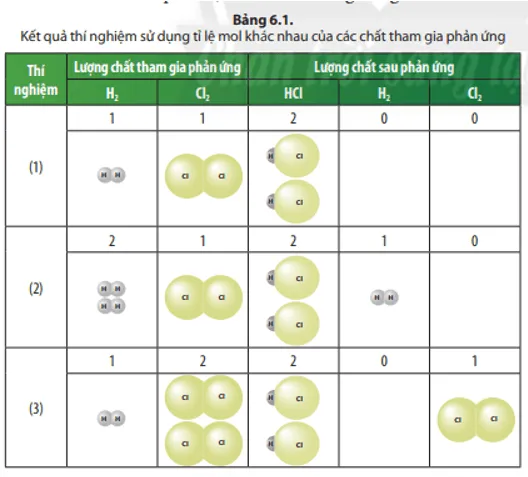
Trả lời:
Sản phẩm tạo thành trong 3 thí nghiệm là: HCl;
Để xác định lượng sản phẩm tạo thành cần dựa vào lượng chất thiếu.
Câu 5
Để tính được khối lượng vôi sống sau khi nung ta thực hiện như thế nào?
Trả lời:
Để tính được khối lượng vôi sống sau khi nung ta thực hiện theo các bước sau:
Bước 1: Viết phương trình hoá học và xác định tỉ lệ mol các chất trong phản ứng.
CaCO3 → CaO + CO2
1 : 1 : 1
Bước 2: Tìm số mol CaCO3 phản ứng.
Bước 3: Dựa vào phương trình hoá học tìm số mol CaO tạo thành.
Theo phản ứng, tỉ lệ mol giữa các chất bằng nhau nên số mol các chất cũng bằng nhau:
nCaO=nCaCO3=0,25 (mol).
Bước 4: Chuyển đổi số mol chất thành khối lượng:
mCaO = nCaO × MCaO = 0,25 × 56 = 14 (gam).
Câu 6
Hãy trình bày cách tính thể tích khí chlorine đã tham gia phản ứng ở Ví dụ 2.
Trả lời:
Cách tính thể tích khí chlorine:
Bước 1: Viết phương trình hoá học và xác định tỉ lệ các chất trong phản ứng.
2Al + 3Cl2 → 2AlCl3
2 : 3 : 2
Bước 2: Tìm số mol AlCl3 tạo thành sau phản ứng:
Bước 3: Dựa vào phương trình hoá học tìm số mol khí chlorine tham gia:
Theo tỉ lệ mol của phản ứng, ta có:
Bước 4: Chuyển đổi số mol chất thành thể tích:
Câu 7
Em có nhận xét gì về khối lượng thực tế và khối lượng lí thuyết thu được của ammonia.
Trả lời:
Khối lượng ammonia thực tế bằng ¼ khối lượng ammonia lý thuyết.
Câu 8:
Để tính được hiệu suất phản ứng ta cần biết những thông tin gì?
Trả lời:
Để tính được hiệu suất phản ứng ta cần biết lượng sản phẩm thực tế và lượng sản phẩm lí thuyết. Trong đó, lượng lí thuyết và lượng thực tế lấy cùng đơn vị đo.
Luyện tập Khoa học tự nhiên 8 Bài 6 CTST
Luyện tập trang 33
Đốt cháy hoàn toàn 6,2 gam phosphorus trong khí oxygen. Hãy tính thể tích khí oxygen (đkc) và khối lượng sản phẩm tạo thành theo phản ứng: 4P + 5O2 → 2P2O5.
Trả lời:
Phương trình hoá học: 4P + 5O2 → 2P2O5
Tỉ lệ các chất: 4 : 5 : 2
Số mol phosphorus đã bị đốt cháy:
Theo tỉ lệ mol của phản ứng, ta có:
Luyện tập trang 34
Cho 0,50 mol khí hydrogen tác dụng với 0,45 mol hơi iodine thu được 0,60 mol khí hydrogen iodide. Tính hiệu suất phản ứng.

