Download.vn Học tập Lớp 12 Hóa học 12
Bạn đang đọc: Tổng hợp kiến thức môn Hóa học 12
Tổng hợp kiến thức môn Hóa học 12 Lý thuyết lớp 12 môn Hóa Học
Giới thiệu Tải về Bình luận
- 7
Mua tài khoản Download Pro để trải nghiệm website Download.vn KHÔNG quảng cáo & tải File cực nhanh chỉ từ 79.000đ. Tìm hiểu thêm Mua ngay
Tổng hợp kiến thức môn Hóa học lớp 12 là tài liệu cực kì hữu ích mà Download.vn muốn giới thiệu đến quý thầy cô cùng các bạn học sinh tham khảo.
Tổng hợp kiến thức Hóa 12 bao gồm 49 trang tóm tắt toàn bộ lý thuyết cơ bản Hóa học và bài tập trắc nghiệm của các chương. Hy vọng với tài liệu này các bạn có thêm nhiều tài liệu tham khảo củng cố kiến thức môn Hóa học để đạt được kết quả cao trong các bài kiểm tra, bài thi THPT Quốc gia 2021 sắp tới. Chúc các bạn học tốt.
Tổng hợp kiến thức Hóa 12
 Sách Giải – Người Thầy của bạn https://sachgiai.com/ 1CHƯƠNG I. ESTE – LIPIT A- MỘT SỐ VẤN ĐỀ LÍ THUYẾT CẦN NẮM VỮNG1. Khái niệm về dẫn xuất của axit cacboxylic – Dẫn xuất của axit cacboxylic là những sản phẩm tạo ra khi thay thế nhóm hiđroxyl -OH trong nhóm cacboxyl -COOH bằng nguyên tử hay nhóm nguyên tử khác: -COOH -COZ (với Z: OR’, NH2, OCOR, halogen, …)- Este là dẫn xuất của axit cacboxylic. Khi thay thế nhóm OH ở nhóm cacboxyl của axitcacboxylic bằng nhóm OR’ thì được este.- Halogenua axit (quan trọng nhất là clorua axit RCOCl). Để tạo ra halogenua axit cóthể dùng các tác nhân như PCl5 (photpho pentaclorua), PCl3 (photpho triclorua), COCl2(photgen), SOCl2(thionyl clorua), … RCOOH + PCl5 RCOCl + POCl3+ HCl 3RCOOH + PCl3 3RCOCl + H3PO3 RCOOH + SOCl2 RCOCl + SO2+ HCl RCOOH + COCl2 RCOCl + CO2+ HCl- Anhiđrit axit, có 2 loại: đối xứng (dạng (RCO)2O hoặc (ArCO)2O; gọi tên bằng cáchthay từ axit bằng anhiđrit (CH3CO)2O là anhiđrit axetic), và không cân đối (sinh ra từ haiaxit monocacboxylic khác nhau như CH3CO-O-OCC6H5; gọi tên bằng từ anhiđrit cộng vớitên của hai axit – anhiđrit axetic benzoic).Để tạo thành anhiđrit axit có thể sử dụng nhiều phương pháp khác nhau như dùng tácnhân hút nước P2O5hay tác dụng của nhiệt, …2. ESTE .2.1. Khái niệm : Khi thay nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR thì được este* Công thức tổng quát của este a/ Trường hợp đơn giản: là este không chứa nhóm chức nào khác, ta có các công thức như sau – Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đơn chức R’OH: RCOOR’. – Tạo bởi axit cacboxylic đa chức R(COOH)avà ancol đơn chức R’OH: R(COOR’)a.- Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đa chức R’(OH)b: (RCOO)bR’.– Tạo bởi axit cacboxylic đa chức R(COOH)avà ancol đa chức R‘(OH)b: Rb(COO)abR‘a.Trong đó, R và R’ là gốc hiđrocacbon (no, không no hoặc thơm); trường hợp đặc biệt, Rcó thể là H (đó là este của axit fomic H-COOH).b/Trường hợp phức tạp: là trường hợp este còn chứa nhóm OH (hiđroxi este) hoặc este còn chứa nhóm COOH (este – axit) hoặc các este vòng nội phân tử … Este trong trườnghợp này sẽ phải xét cụ thể mà không thể có CTTQ chung được. Ví dụ với glixerol và axitaxetic có thể có các hiđroxi este như HOC3H5(OOCCH3)2hoặc (HO)2C3H5OOCCH3; hoặcvới axit oxalic và metanol có thể có este – axit là HOOC-COOCH3.c/ Công thức tổng quát dạng phân tử của este không chứa nhóm chức khác Nên sử dụng CTTQ dạngn 2n + 2 2 2aC H O (trong đó n là số cacbon trong phân tửeste n ≥ 2, nguyên; là tổng số liên kết và số vòng trong phân tử ≥ 1, nguyên; a là sốnhóm chức este a ≥ 1, nguyên), để viết phản ứng cháy hoặc thiết lập công thức theo phầntrăm khối lượng của nguyên tố cụ thể.* Este đơn chức RCOOR,Trong đó R là gốc hidrocacbon hay H; R’là gốc hidrocacbon* Este no đơn chức CnH2nO2( với n2)Tên của este :Tên gốc R’+ tên gốc axit RCOO (đuôi at)Vd : CH3COOC2H5 : Etylaxetat CH2=CH- COOCH3metyl acrylat
Sách Giải – Người Thầy của bạn https://sachgiai.com/ 1CHƯƠNG I. ESTE – LIPIT A- MỘT SỐ VẤN ĐỀ LÍ THUYẾT CẦN NẮM VỮNG1. Khái niệm về dẫn xuất của axit cacboxylic – Dẫn xuất của axit cacboxylic là những sản phẩm tạo ra khi thay thế nhóm hiđroxyl -OH trong nhóm cacboxyl -COOH bằng nguyên tử hay nhóm nguyên tử khác: -COOH -COZ (với Z: OR’, NH2, OCOR, halogen, …)- Este là dẫn xuất của axit cacboxylic. Khi thay thế nhóm OH ở nhóm cacboxyl của axitcacboxylic bằng nhóm OR’ thì được este.- Halogenua axit (quan trọng nhất là clorua axit RCOCl). Để tạo ra halogenua axit cóthể dùng các tác nhân như PCl5 (photpho pentaclorua), PCl3 (photpho triclorua), COCl2(photgen), SOCl2(thionyl clorua), … RCOOH + PCl5 RCOCl + POCl3+ HCl 3RCOOH + PCl3 3RCOCl + H3PO3 RCOOH + SOCl2 RCOCl + SO2+ HCl RCOOH + COCl2 RCOCl + CO2+ HCl- Anhiđrit axit, có 2 loại: đối xứng (dạng (RCO)2O hoặc (ArCO)2O; gọi tên bằng cáchthay từ axit bằng anhiđrit (CH3CO)2O là anhiđrit axetic), và không cân đối (sinh ra từ haiaxit monocacboxylic khác nhau như CH3CO-O-OCC6H5; gọi tên bằng từ anhiđrit cộng vớitên của hai axit – anhiđrit axetic benzoic).Để tạo thành anhiđrit axit có thể sử dụng nhiều phương pháp khác nhau như dùng tácnhân hút nước P2O5hay tác dụng của nhiệt, …2. ESTE .2.1. Khái niệm : Khi thay nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR thì được este* Công thức tổng quát của este a/ Trường hợp đơn giản: là este không chứa nhóm chức nào khác, ta có các công thức như sau – Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đơn chức R’OH: RCOOR’. – Tạo bởi axit cacboxylic đa chức R(COOH)avà ancol đơn chức R’OH: R(COOR’)a.- Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đa chức R’(OH)b: (RCOO)bR’.– Tạo bởi axit cacboxylic đa chức R(COOH)avà ancol đa chức R‘(OH)b: Rb(COO)abR‘a.Trong đó, R và R’ là gốc hiđrocacbon (no, không no hoặc thơm); trường hợp đặc biệt, Rcó thể là H (đó là este của axit fomic H-COOH).b/Trường hợp phức tạp: là trường hợp este còn chứa nhóm OH (hiđroxi este) hoặc este còn chứa nhóm COOH (este – axit) hoặc các este vòng nội phân tử … Este trong trườnghợp này sẽ phải xét cụ thể mà không thể có CTTQ chung được. Ví dụ với glixerol và axitaxetic có thể có các hiđroxi este như HOC3H5(OOCCH3)2hoặc (HO)2C3H5OOCCH3; hoặcvới axit oxalic và metanol có thể có este – axit là HOOC-COOCH3.c/ Công thức tổng quát dạng phân tử của este không chứa nhóm chức khác Nên sử dụng CTTQ dạngn 2n + 2 2 2aC H O (trong đó n là số cacbon trong phân tửeste n ≥ 2, nguyên; là tổng số liên kết và số vòng trong phân tử ≥ 1, nguyên; a là sốnhóm chức este a ≥ 1, nguyên), để viết phản ứng cháy hoặc thiết lập công thức theo phầntrăm khối lượng của nguyên tố cụ thể.* Este đơn chức RCOOR,Trong đó R là gốc hidrocacbon hay H; R’là gốc hidrocacbon* Este no đơn chức CnH2nO2( với n2)Tên của este :Tên gốc R’+ tên gốc axit RCOO (đuôi at)Vd : CH3COOC2H5 : Etylaxetat CH2=CH- COOCH3metyl acrylat 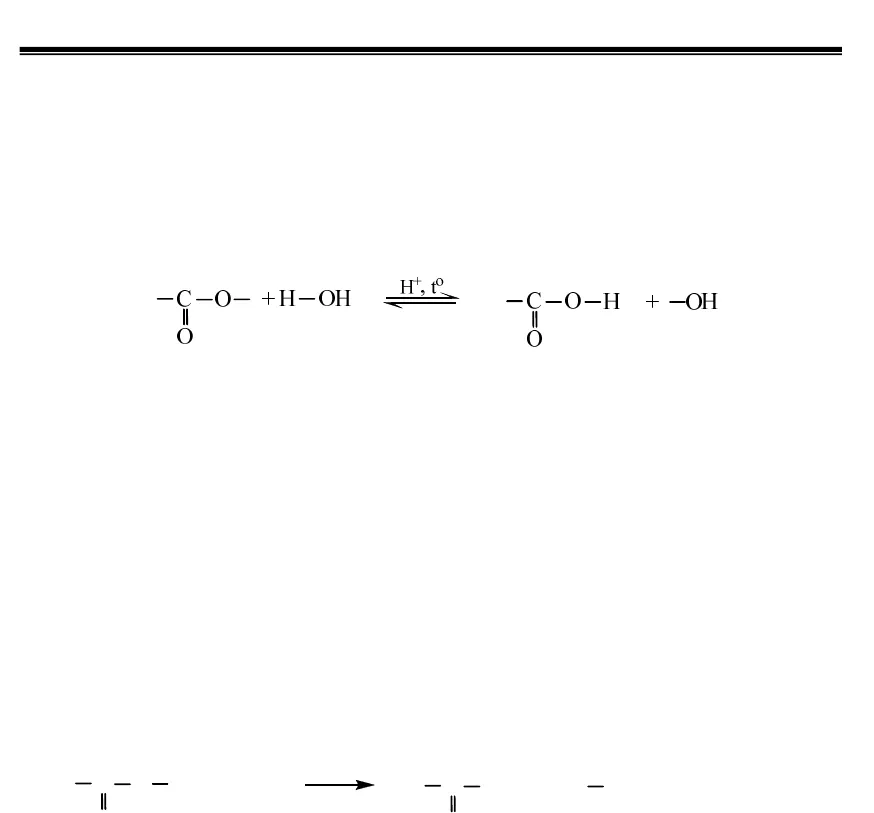 Sách Giải – Người Thầy của bạn https://sachgiai.com/ 22.2.Lí tính :- nhiệt độ sôi ,độ tan trong nước thấp hơn axit và ancol có cùng số cacbon : axit > ancol > este-Một số mùi đặc trưng : Isoamyl axetat : mùi chuối chín ; Etyl butiat ,etyl propionat cómùi dứa2.3 TÍNH CHẤT HÓA HỌC :1. Phản ứng thủy phânTính chất hoá học quan trọng nhất của este là phản ứng thuỷ phân. Sơ đồ thuỷ phâneste (về cơ bản, chưa xét các trường hợp đặc biệt) là : (este) (nước) (axit) (ancol)Thuỷ phân chính là quá trình nghịch của của phản ứng este hoá. Phản ứng thuỷ phân có thể xảy ra trong môi trường axit hoặc môi trường bazơ.- Phản ứng thuỷ phân trong môi trường kiềm được gọi là phản ứng xà phòng hoá.Đặc điểm của phản ứng thuỷ phân este:- Phản ứng thuỷ phân este trong môi trường axit là phản ứng thuận nghịch. Sản phẩm củaphản ứng trong điều kiện này luôn có axit cacboxylic. Để chuyển dịch cân bằng về phía tạo axit và ancol, ta dùng lượng dư nước.- Phản ứng thuỷ phân este không những thuận nghịch mà còn rất chậm. Để tăng tốc độ phản ứng thuỷ phân ta đun nóng hỗn hợp phản ứng với với chất xúc tác axit (H2SO4,HCl…).- Phản ứng xà phòng hoá chỉ xảy ra một chiều, sản phẩm thu được luôn có muối của axitcacboxylic.C OO+ OH-toC O-O+ OH(este) (kiềm) (muối) (ancol, phenol, anđehit…)a.Thủy phân trong môi trường axit :tạo ra 2 lớp chất lỏng , là phản ứng thuận nghịch (2 chiều )RCOOR,+ H2O2 4oH SO dtRCOOH + R,OHb.Thủy phân trong môi trường bazơ ( Phản ứng xà phòng hóa ) : là phản ứng 1 chiều RCOOR,+ NaOH0tRCOONa + R,OH* ESTE đốt cháy tạo thành CO2và H2O .2 2CO H On nta suy ra este đó là este no đơn chức ,hở (CnH2nO2)2/ Phản ứng của gốc hiđrocacbon Este không no (este của axit không no hoặc ancol không no) có khả năng tham gia phản ứng cộng và phản ứng trùng hợp – đây là tính chất do liên kết quy định (tương tự nhưhiđrocacbon tương ứng). Một số phản ứng thuộc loại này có ứng dụng quan trọng là :- Phản ứng chuyển hoá dầu (chất béo lỏng) thành mỡ (chất béo rắn) (C17H33COO)3C3H5+ 3H20Ni, t, p(C17H35COO)3C3H5 (Triolein) (Tristearin)- Phản ứng trùng hợp vinyl axetat thành poli(vinyl axetat)
Sách Giải – Người Thầy của bạn https://sachgiai.com/ 22.2.Lí tính :- nhiệt độ sôi ,độ tan trong nước thấp hơn axit và ancol có cùng số cacbon : axit > ancol > este-Một số mùi đặc trưng : Isoamyl axetat : mùi chuối chín ; Etyl butiat ,etyl propionat cómùi dứa2.3 TÍNH CHẤT HÓA HỌC :1. Phản ứng thủy phânTính chất hoá học quan trọng nhất của este là phản ứng thuỷ phân. Sơ đồ thuỷ phâneste (về cơ bản, chưa xét các trường hợp đặc biệt) là : (este) (nước) (axit) (ancol)Thuỷ phân chính là quá trình nghịch của của phản ứng este hoá. Phản ứng thuỷ phân có thể xảy ra trong môi trường axit hoặc môi trường bazơ.- Phản ứng thuỷ phân trong môi trường kiềm được gọi là phản ứng xà phòng hoá.Đặc điểm của phản ứng thuỷ phân este:- Phản ứng thuỷ phân este trong môi trường axit là phản ứng thuận nghịch. Sản phẩm củaphản ứng trong điều kiện này luôn có axit cacboxylic. Để chuyển dịch cân bằng về phía tạo axit và ancol, ta dùng lượng dư nước.- Phản ứng thuỷ phân este không những thuận nghịch mà còn rất chậm. Để tăng tốc độ phản ứng thuỷ phân ta đun nóng hỗn hợp phản ứng với với chất xúc tác axit (H2SO4,HCl…).- Phản ứng xà phòng hoá chỉ xảy ra một chiều, sản phẩm thu được luôn có muối của axitcacboxylic.C OO+ OH-toC O-O+ OH(este) (kiềm) (muối) (ancol, phenol, anđehit…)a.Thủy phân trong môi trường axit :tạo ra 2 lớp chất lỏng , là phản ứng thuận nghịch (2 chiều )RCOOR,+ H2O2 4oH SO dtRCOOH + R,OHb.Thủy phân trong môi trường bazơ ( Phản ứng xà phòng hóa ) : là phản ứng 1 chiều RCOOR,+ NaOH0tRCOONa + R,OH* ESTE đốt cháy tạo thành CO2và H2O .2 2CO H On nta suy ra este đó là este no đơn chức ,hở (CnH2nO2)2/ Phản ứng của gốc hiđrocacbon Este không no (este của axit không no hoặc ancol không no) có khả năng tham gia phản ứng cộng và phản ứng trùng hợp – đây là tính chất do liên kết quy định (tương tự nhưhiđrocacbon tương ứng). Một số phản ứng thuộc loại này có ứng dụng quan trọng là :- Phản ứng chuyển hoá dầu (chất béo lỏng) thành mỡ (chất béo rắn) (C17H33COO)3C3H5+ 3H20Ni, t, p(C17H35COO)3C3H5 (Triolein) (Tristearin)- Phản ứng trùng hợp vinyl axetat thành poli(vinyl axetat) Sách Giải – Người Thầy của bạn https://sachgiai.com/ 3CH2CH OCOCH3xt, to, pCH CH2OCOCH3nn- Trùng hợp metyl metacrylat thành poli(metyl metacrylat) – thuỷ tinh hữu cơ plexiglas).nCH2CH COOCH3CH3xt, to, pmetyl metacrylatpoli(metyl metacrylat) (PMM)CH CH2CH3COOCH3n- Phản ứng tráng gương của este của axit fomic– (xem lại anđehit).3. Phản ứng khử este bởi líti-nhôm hiđrua LiAlH4thành ancol bậc I RCOOR’4+31) LiAlH2) H ORCH2OH + R’OH (Chú ý: anhiđrit axit, halogenua axit cũng bị líti-nhôm hiđrua khử tương tự).4. Một số phản ứng thuỷ phân đặc biệt của este Căn cứ vào sơ đồ phản ứng xà phòng hoá hay phản ứng thuỷ phân este ta có thểcăn cứ vào sản phẩm tạo thành để suy đoán cấu tạo của este ban đầu. Không nhất thiết sản phẩm cuối cùng phải có ancol, tuỳ thuộc vào việc nhóm –OHđính vào gốc hiđrocacbon có cấu tạo như thế nào mà sẽ có các phản ứng tiếp theo xảy ra đểcó sản phẩm cuối cùng hoàn toàn khác nhau, hoặc nữa là do cấu tạo bất thường của estegây nên. Một số trường hợp thuỷ phân đặc biệt của este (không chứa halogen) thường gặptrong bài toán định lượng là : Este + NaOH 1 muối + 1 anđehit Este đơn chức có gốc ancol dạng công thức R-CH=CH-Thí dụ CH3COOCH=CH-CH3 Este + NaOH 1 muối + 1 xeton Este đơn chức với dạng công thức R’ –COO – C(R)=C(R”)R’’’Thí dụ : CH3-COO-C(CH3)= CH2tạo axeton khi thuỷ phân. Este + NaOH 1 muối + 1 ancol + H2O Este– axit : HOOC-R-COOR’ Este + NaOH 2 muối + H2O Este của phenol: C6H5OOC-R Este + NaOH 1 muối + anđehit + H2O Hiđroxi– este: RCOOCH(OH)-R’ Este + NaOH 1 muối + xeton + H2O Hiđroxi– este: RCOOC(R)(OH)-R’ Este + NaOH 1 sản phẩm duy nhấthoặc “mRẮN= mESTE+ mNaOH”. Este vòng (được tạo bởi hiđroxi axit) Este + NaOH Có MSP= MEste+ MNaOH Đây chính là este vòng nhưng được nhìn dưới góc độ khác mà thôi Chú ý các kết luận in nghiêng ngay dưới mỗi trường hợp trên đây chỉ là một thí dụđơn giản nhất, các em chỉ được vận dụng khi không có dấu hiệu cho phép xác định cụ thểsố nhóm chức este trước đó.IV.ĐIỀU CHẾ.
Sách Giải – Người Thầy của bạn https://sachgiai.com/ 3CH2CH OCOCH3xt, to, pCH CH2OCOCH3nn- Trùng hợp metyl metacrylat thành poli(metyl metacrylat) – thuỷ tinh hữu cơ plexiglas).nCH2CH COOCH3CH3xt, to, pmetyl metacrylatpoli(metyl metacrylat) (PMM)CH CH2CH3COOCH3n- Phản ứng tráng gương của este của axit fomic– (xem lại anđehit).3. Phản ứng khử este bởi líti-nhôm hiđrua LiAlH4thành ancol bậc I RCOOR’4+31) LiAlH2) H ORCH2OH + R’OH (Chú ý: anhiđrit axit, halogenua axit cũng bị líti-nhôm hiđrua khử tương tự).4. Một số phản ứng thuỷ phân đặc biệt của este Căn cứ vào sơ đồ phản ứng xà phòng hoá hay phản ứng thuỷ phân este ta có thểcăn cứ vào sản phẩm tạo thành để suy đoán cấu tạo của este ban đầu. Không nhất thiết sản phẩm cuối cùng phải có ancol, tuỳ thuộc vào việc nhóm –OHđính vào gốc hiđrocacbon có cấu tạo như thế nào mà sẽ có các phản ứng tiếp theo xảy ra đểcó sản phẩm cuối cùng hoàn toàn khác nhau, hoặc nữa là do cấu tạo bất thường của estegây nên. Một số trường hợp thuỷ phân đặc biệt của este (không chứa halogen) thường gặptrong bài toán định lượng là : Este + NaOH 1 muối + 1 anđehit Este đơn chức có gốc ancol dạng công thức R-CH=CH-Thí dụ CH3COOCH=CH-CH3 Este + NaOH 1 muối + 1 xeton Este đơn chức với dạng công thức R’ –COO – C(R)=C(R”)R’’’Thí dụ : CH3-COO-C(CH3)= CH2tạo axeton khi thuỷ phân. Este + NaOH 1 muối + 1 ancol + H2O Este– axit : HOOC-R-COOR’ Este + NaOH 2 muối + H2O Este của phenol: C6H5OOC-R Este + NaOH 1 muối + anđehit + H2O Hiđroxi– este: RCOOCH(OH)-R’ Este + NaOH 1 muối + xeton + H2O Hiđroxi– este: RCOOC(R)(OH)-R’ Este + NaOH 1 sản phẩm duy nhấthoặc “mRẮN= mESTE+ mNaOH”. Este vòng (được tạo bởi hiđroxi axit) Este + NaOH Có MSP= MEste+ MNaOH Đây chính là este vòng nhưng được nhìn dưới góc độ khác mà thôi Chú ý các kết luận in nghiêng ngay dưới mỗi trường hợp trên đây chỉ là một thí dụđơn giản nhất, các em chỉ được vận dụng khi không có dấu hiệu cho phép xác định cụ thểsố nhóm chức este trước đó.IV.ĐIỀU CHẾ. 
