Download.vn Học tập Lớp 9
Bạn đang đọc: Bảng hệ thống hóa các loại hợp chất vô cơ
Bảng hệ thống hóa các loại hợp chất vô cơ Tài liệu học tập môn Hóa lớp 9
Giới thiệu Tải về Bình luận
- 6
Mua tài khoản Download Pro để trải nghiệm website Download.vn KHÔNG quảng cáo & tải File cực nhanh chỉ từ 79.000đ. Tìm hiểu thêm Mua ngay
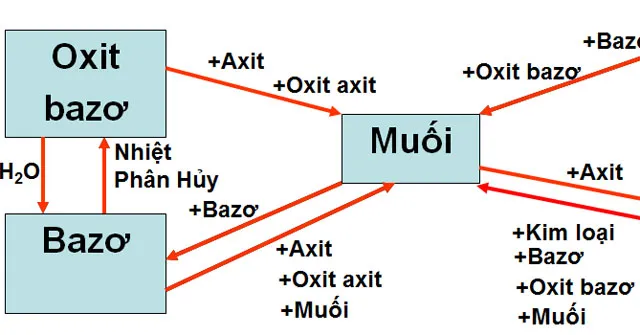
Bảng hệ thống hóa các loại hợp chất vô cơ là tài liệu hóa học dành cho các bạn học sinh lớp 9 muốn hệ thống hóa lại kiến thức của mình một cách khoa học, bài bản.
Bảng hệ thống hóa các loại hợp chất vô cơ được biên soạn một cách chính xác, có hệ thống giúp cho người học nắm vững được những kiến thức căn bản như oxit, axit, bazo, muối xoay quanh khái niệm, tính chất tổng quát và phân loại. Đây là những kiến thức cần thiết, nắm vững bạn mới có thể thực hành và ứng dụng làm bài tập một cách tốt nhất, đạt kết quả cao nhất. Mời các bạn cùng tham khảo và tải tài liệu tại đây.
Bảng hệ thống hóa các loại hợp chất vô cơ
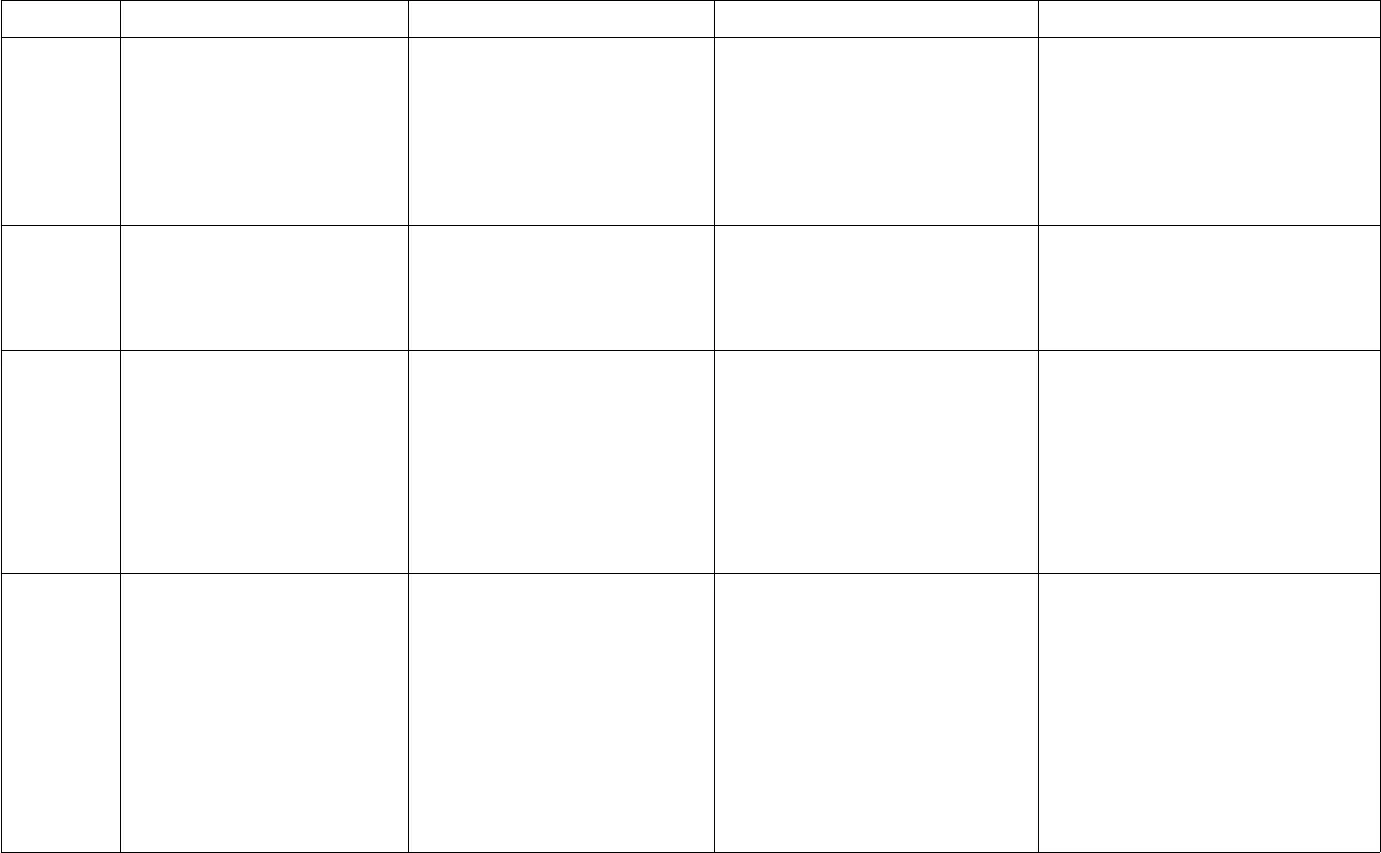 B¶ng hÖ thèng hãa: c¸c lo¹i hîp chÊt v« c¬oxitaxitBaz¬MuèiKh¸iniÖmLµ hîp chÊt cña 2nguyªn tè trong ®ã cãmét nguyªn tè lµ oxiLµ hîp chÊt mµ ph©n tögåm 1 hay nhiÒu nguyªntö hidro liªn kÐt víi métgèc axit. C¸c nguyên töhidro nµy cã thÓ thay thÕbëi nguyªn tö kim lo¹iLµ hîp chÊt mµ ph©n tögåm mét nguyªn tö kimläai liªn kÕt víi mét haynhiÒu nhãm hidroxit (-OH)Lµ hîp chÊt mµ ph©n tö gåmmét hay nhiÒu nguyªn tökim lo¹i liªn kÕt víi méthay nhiÒu gèc axitCTHHtængqu¸tMxOytrong ®ã:M lµ KHHH cña kimlo¹i hoÆc phi kim; HãatrÞ cña M lµ 2y/xHnR trong ®ã:R lµ gèc axit; n lµ hãa trÞcña gèc axitM(OH)ntrong ®ã:M lµ KHHH cña kim lo¹i;n lµ hãa trÞ cña kim lo¹i.MxRytrong ®ã:M lµ KHHH cña kim lo¹i Rlµ gèc axit; x,y lµ c¸c chØ sèPh©nlo¹i- oxit ba z¬- oxit axit- oxit lìng tÝnh- oxit trung tÝnhTheo thµnh phÇn:- axit cã oxi- axit kh«ng cã oxiTheo tÝnh chÊt:- axit m¹nh: HCl. HNO3.H2SO4…- axit yÕu: H2CO3, H2S…Ba z¬ tan trongníc( kiÒm): NaOH,KOH,Ca(OH)2, Ba(OH)2…- Ba z¬ kh«ng tan:Cu(OH)2, Mg(OH)2,Fe(OH)2, Fe(OH)3…- Muèi trung hßa: CaCO3,Na2SO4, Cu(NO3)2…- Muèi axit:NaHCO3,NaHSO4,Ca(H2PO4)2…TÝnhchÊtHãahäc- oxit axit + níc ->axitSO3+ H2O ->H2SO4- oxit ba z¬ + níc – >ba z¬CaO + H2O -> Ca(OH)2- oxit ba z¬ + axit->muèi + nícMgO + 2HCl -> MgCl2- dung dÞch axit lµm qu×tÝm ®æi sang mµu ®á.- axit + kim lo¹i -> muèi+ níc2HCl + Zn -> ZnCl2+ H2- axit + ba z¬ – > muèi +nícHCl + NaOH -> NaCl +H2O- Dung dÞch ba z¬ lµm quútÝm ®æi sang mµu xanh,lµm phenolphtalein ®æisang mµu ®á.- ba z¬ + axit -> muèi +nícCu(OH)2+ 2HCl -> CuCl2+ 2H2O- Ba z¬ kiÒm + oxitaxit ->- Muèi + axit -> muèi míi +axit míi2HCl + CaCO3-> CaCl2+H2O + CO2- dd muèi + ba z¬ -> muèimíi + ba z¬ míiNa2CO3+ Ca(OH)2->CaCO3+ 2NaOH- dd muèi + dd muèi – > 2
B¶ng hÖ thèng hãa: c¸c lo¹i hîp chÊt v« c¬oxitaxitBaz¬MuèiKh¸iniÖmLµ hîp chÊt cña 2nguyªn tè trong ®ã cãmét nguyªn tè lµ oxiLµ hîp chÊt mµ ph©n tögåm 1 hay nhiÒu nguyªntö hidro liªn kÐt víi métgèc axit. C¸c nguyên töhidro nµy cã thÓ thay thÕbëi nguyªn tö kim lo¹iLµ hîp chÊt mµ ph©n tögåm mét nguyªn tö kimläai liªn kÕt víi mét haynhiÒu nhãm hidroxit (-OH)Lµ hîp chÊt mµ ph©n tö gåmmét hay nhiÒu nguyªn tökim lo¹i liªn kÕt víi méthay nhiÒu gèc axitCTHHtængqu¸tMxOytrong ®ã:M lµ KHHH cña kimlo¹i hoÆc phi kim; HãatrÞ cña M lµ 2y/xHnR trong ®ã:R lµ gèc axit; n lµ hãa trÞcña gèc axitM(OH)ntrong ®ã:M lµ KHHH cña kim lo¹i;n lµ hãa trÞ cña kim lo¹i.MxRytrong ®ã:M lµ KHHH cña kim lo¹i Rlµ gèc axit; x,y lµ c¸c chØ sèPh©nlo¹i- oxit ba z¬- oxit axit- oxit lìng tÝnh- oxit trung tÝnhTheo thµnh phÇn:- axit cã oxi- axit kh«ng cã oxiTheo tÝnh chÊt:- axit m¹nh: HCl. HNO3.H2SO4…- axit yÕu: H2CO3, H2S…Ba z¬ tan trongníc( kiÒm): NaOH,KOH,Ca(OH)2, Ba(OH)2…- Ba z¬ kh«ng tan:Cu(OH)2, Mg(OH)2,Fe(OH)2, Fe(OH)3…- Muèi trung hßa: CaCO3,Na2SO4, Cu(NO3)2…- Muèi axit:NaHCO3,NaHSO4,Ca(H2PO4)2…TÝnhchÊtHãahäc- oxit axit + níc ->axitSO3+ H2O ->H2SO4- oxit ba z¬ + níc – >ba z¬CaO + H2O -> Ca(OH)2- oxit ba z¬ + axit->muèi + nícMgO + 2HCl -> MgCl2- dung dÞch axit lµm qu×tÝm ®æi sang mµu ®á.- axit + kim lo¹i -> muèi+ níc2HCl + Zn -> ZnCl2+ H2- axit + ba z¬ – > muèi +nícHCl + NaOH -> NaCl +H2O- Dung dÞch ba z¬ lµm quútÝm ®æi sang mµu xanh,lµm phenolphtalein ®æisang mµu ®á.- ba z¬ + axit -> muèi +nícCu(OH)2+ 2HCl -> CuCl2+ 2H2O- Ba z¬ kiÒm + oxitaxit ->- Muèi + axit -> muèi míi +axit míi2HCl + CaCO3-> CaCl2+H2O + CO2- dd muèi + ba z¬ -> muèimíi + ba z¬ míiNa2CO3+ Ca(OH)2->CaCO3+ 2NaOH- dd muèi + dd muèi – > 2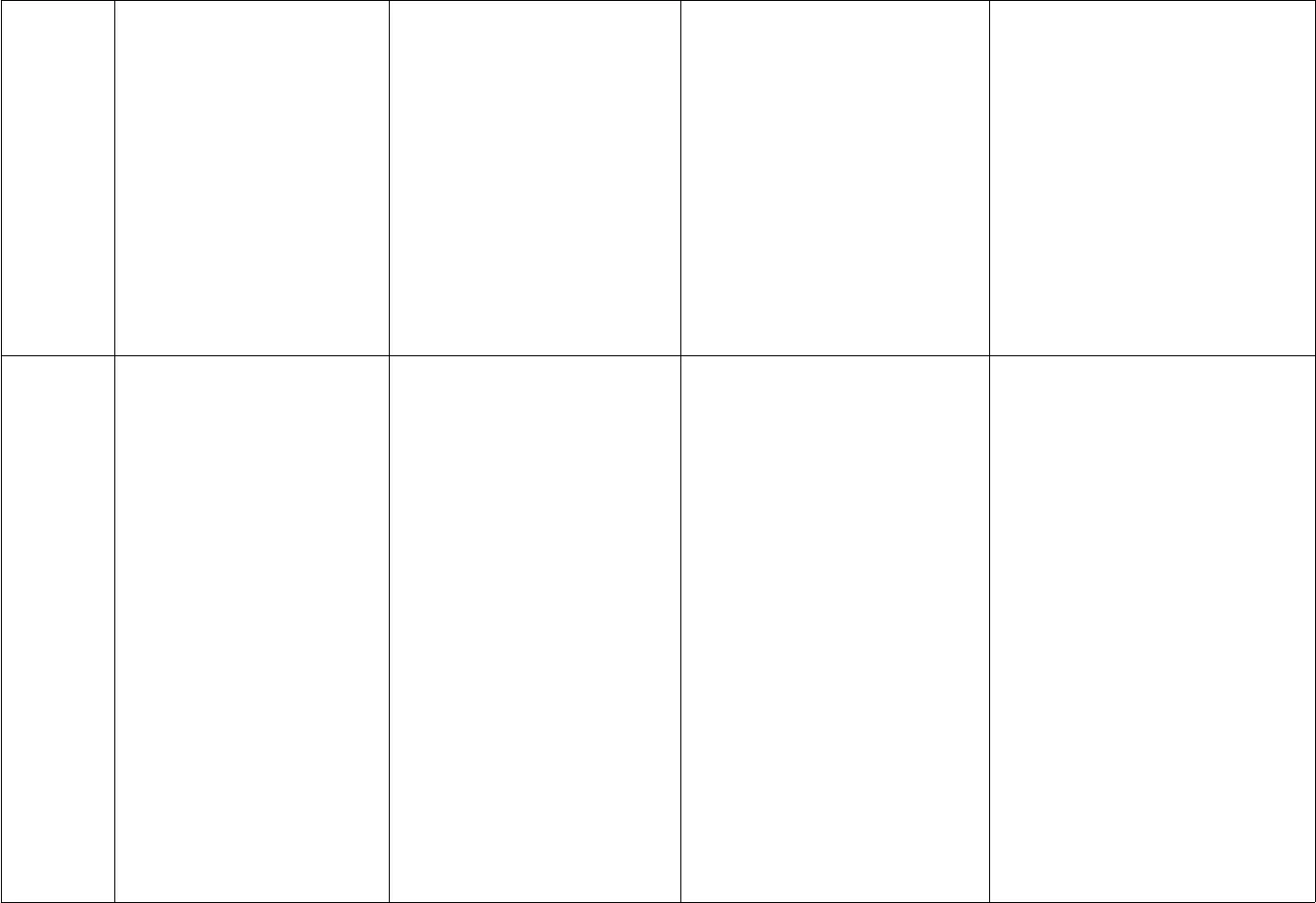 + H2O- oxitaxit + ba z¬ kiÒm-> muèi + nícCO2+ NaOH ->Na2CO3+ H2O- oxitaxit + oxitba z¬-> muèiCO2+ CaO -> CaCO3- axit + oxit ba z¬ ->muèi + nícH2SO4+ CuO -> CuSO4+ H2O- axit + muèi -> muèimíi + axit míiH2SO4+ Na2SO3->Na2SO4+ H2O + SO2muèi + níc2KOH + N2O5-> 2KNO3+H2O- ba z¬ kiÒm + dd muèi ->Muèi míi + ba z¬ míi2NaOH + CuSO4->Na2SO4+ Cu(OH)2- Ba z¬ kh«ng tan bÞ nhiÖtph©n hñy thµnh oxit ba z¬t¬ng øng + nícMg(OH)2-> MgO + H2Omuèi míiNa2SO4+ BaCl2-> 2NaCl +BaSO4- dd muèi + kim lo¹i ->muèi míi + kim lo¹i míi.CuSO4+ Zn -> ZnSO4+ CunhiÒu muèi bÞ ph©n hñy ënhiÖt ®é cao.MgCO3-> MgO + CO22KMnO4-> K2MnO4+MnO2+ O2§iÒuchÕ1.kim lo¹i + oxi->oxitba z¬2Cu + O2-> 2CuO2.Phi kim + Oxi ->oxitaxitS + O2-> SO23.Ba z¬ kh«ng tan->oxitba z¬ + nícCu(OH)2-> CuO +H2O4.Axit —> Níc +oxitaxit (anhidrit)5.Muèi cacbonatoxitba z¬ + CO2CaCO3—> CaO + CO26.Muèi nitrat -> oxit+…2Cu(NO3)2-> 2CuO +1.Phi kim +hidro( +H2O) -> dd axithidricH2+ Cl2-> 2HCl2. oxit axit + H2O -> ddaxitSO3+ H2O -> H2SO43. axit + Muèi -> muèimíi + axit míiH2SO4+ BaCl2 -> BaSO4+ HCl4. §iÖn ph©n muèi:CuSO4+ 2H2O-> Cu +O2+ 2H2SO41.Kim lo¹i (kiÒm, kiÒmthæ) + H2O-> ba z¬ kiÒm2K + 2H2O -> 2KOH + H22. oxit ba z¬ kiÒm + H2O-> dd kiÒmBaO + H2O -> Ba(OH)23. dd kiÒm + dd muèi ->muèi míi + ba z¬ míiNa2CO3+ Ca(OH)2->2NaOH + CaCO34. ®iÖn ph©n dd muèi:2NaCl + 2H2O-> 2NaOH+ H2+ Cl21.axit + ba z¬ -> Muèi +H2OHCl + NaOH -> NaCl +H2O2. axit + oxit ba z¬ -> muèi+ H2OH2SO4+ CuO -> CuSO4+H2O3. axit + kim lo¹i -> muèi +H2H2SO4+ Zn -> ZnSO4+ H24. axit + muèi -> muèi míi+ axit míiCuCl2+ H2S -> CuS + 2HCl5.Ba z¬ kiÒm+ dd muèi ->muèi míi + ba z¬ míi.2KOH + CuCl2-> 2KCl +Cu(OH)2
+ H2O- oxitaxit + ba z¬ kiÒm-> muèi + nícCO2+ NaOH ->Na2CO3+ H2O- oxitaxit + oxitba z¬-> muèiCO2+ CaO -> CaCO3- axit + oxit ba z¬ ->muèi + nícH2SO4+ CuO -> CuSO4+ H2O- axit + muèi -> muèimíi + axit míiH2SO4+ Na2SO3->Na2SO4+ H2O + SO2muèi + níc2KOH + N2O5-> 2KNO3+H2O- ba z¬ kiÒm + dd muèi ->Muèi míi + ba z¬ míi2NaOH + CuSO4->Na2SO4+ Cu(OH)2- Ba z¬ kh«ng tan bÞ nhiÖtph©n hñy thµnh oxit ba z¬t¬ng øng + nícMg(OH)2-> MgO + H2Omuèi míiNa2SO4+ BaCl2-> 2NaCl +BaSO4- dd muèi + kim lo¹i ->muèi míi + kim lo¹i míi.CuSO4+ Zn -> ZnSO4+ CunhiÒu muèi bÞ ph©n hñy ënhiÖt ®é cao.MgCO3-> MgO + CO22KMnO4-> K2MnO4+MnO2+ O2§iÒuchÕ1.kim lo¹i + oxi->oxitba z¬2Cu + O2-> 2CuO2.Phi kim + Oxi ->oxitaxitS + O2-> SO23.Ba z¬ kh«ng tan->oxitba z¬ + nícCu(OH)2-> CuO +H2O4.Axit —> Níc +oxitaxit (anhidrit)5.Muèi cacbonatoxitba z¬ + CO2CaCO3—> CaO + CO26.Muèi nitrat -> oxit+…2Cu(NO3)2-> 2CuO +1.Phi kim +hidro( +H2O) -> dd axithidricH2+ Cl2-> 2HCl2. oxit axit + H2O -> ddaxitSO3+ H2O -> H2SO43. axit + Muèi -> muèimíi + axit míiH2SO4+ BaCl2 -> BaSO4+ HCl4. §iÖn ph©n muèi:CuSO4+ 2H2O-> Cu +O2+ 2H2SO41.Kim lo¹i (kiÒm, kiÒmthæ) + H2O-> ba z¬ kiÒm2K + 2H2O -> 2KOH + H22. oxit ba z¬ kiÒm + H2O-> dd kiÒmBaO + H2O -> Ba(OH)23. dd kiÒm + dd muèi ->muèi míi + ba z¬ míiNa2CO3+ Ca(OH)2->2NaOH + CaCO34. ®iÖn ph©n dd muèi:2NaCl + 2H2O-> 2NaOH+ H2+ Cl21.axit + ba z¬ -> Muèi +H2OHCl + NaOH -> NaCl +H2O2. axit + oxit ba z¬ -> muèi+ H2OH2SO4+ CuO -> CuSO4+H2O3. axit + kim lo¹i -> muèi +H2H2SO4+ Zn -> ZnSO4+ H24. axit + muèi -> muèi míi+ axit míiCuCl2+ H2S -> CuS + 2HCl5.Ba z¬ kiÒm+ dd muèi ->muèi míi + ba z¬ míi.2KOH + CuCl2-> 2KCl +Cu(OH)2 4NO2+ O27.hîp chÊt h÷u c¬ +oxi -> oxitCH4+ 2O2-> CO2+2H2O8.Oxi + oxit kimlo¹i(oxit phi kim)->oxit míi2SO2+ O2-> 2 SO34 FeO + O2-> 2Fe2O32CO + O2-> 2CO29.Kim lo¹i +axit(HNO3, H2SO4) ->oxitCu + 4 HNO3->Cu(NO3)2+2NO2+2H2OCu + 2H2SO4– ->CuSO4+ 2H2O + SO26. Ba z¬ kiÒm + oxit axit ->muèi + H2O2NaOH +N2O5-> 2NaNO3+ H2O7. Ba z¬ kiÒm + oxit lìngtÝnh -> muèi + níc2NaOH + Al2O3->2NaAlO2+ H2O8. ba z¬ kiÒm + hidroxitlìng tÝnh->Muèi + níc2KOH + Zn(OH)2->K2ZnO2+ 2H2O9.dd kiÒm + kim lo¹i ->muèi + H22NaOH + 2H2O + 2Al ->2NaAlO2+ 3 H210. Ba z¬ kiÒm + phi kim ->muèi + H2O2NaOH + Cl2-> NaCl +NaClO + H2O11. Kim lo¹i + dd muèi ->muèi míi + kim lo¹i míiCu + 2AgNO3-> Cu(NO3)2+ 2Ag12. Kim lo¹i + phi kim ->muèi2Fe + 3Cl2-> 2FeCl313. Muèi + phi km -> Muèimíi + phi kim míi2KBr + Cl2-> 2KCl + Br2
4NO2+ O27.hîp chÊt h÷u c¬ +oxi -> oxitCH4+ 2O2-> CO2+2H2O8.Oxi + oxit kimlo¹i(oxit phi kim)->oxit míi2SO2+ O2-> 2 SO34 FeO + O2-> 2Fe2O32CO + O2-> 2CO29.Kim lo¹i +axit(HNO3, H2SO4) ->oxitCu + 4 HNO3->Cu(NO3)2+2NO2+2H2OCu + 2H2SO4– ->CuSO4+ 2H2O + SO26. Ba z¬ kiÒm + oxit axit ->muèi + H2O2NaOH +N2O5-> 2NaNO3+ H2O7. Ba z¬ kiÒm + oxit lìngtÝnh -> muèi + níc2NaOH + Al2O3->2NaAlO2+ H2O8. ba z¬ kiÒm + hidroxitlìng tÝnh->Muèi + níc2KOH + Zn(OH)2->K2ZnO2+ 2H2O9.dd kiÒm + kim lo¹i ->muèi + H22NaOH + 2H2O + 2Al ->2NaAlO2+ 3 H210. Ba z¬ kiÒm + phi kim ->muèi + H2O2NaOH + Cl2-> NaCl +NaClO + H2O11. Kim lo¹i + dd muèi ->muèi míi + kim lo¹i míiCu + 2AgNO3-> Cu(NO3)2+ 2Ag12. Kim lo¹i + phi kim ->muèi2Fe + 3Cl2-> 2FeCl313. Muèi + phi km -> Muèimíi + phi kim míi2KBr + Cl2-> 2KCl + Br2